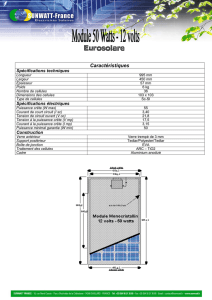
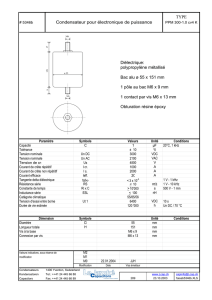
Le développement embryonnaire du système - iPubli

SYNTHÈSE
L
à
à
à
([ 1]

à
à
à
vo
à
à
à
à
à
•

!) . à
à à
à
à
à
à

R,
°

M
u
m
M
u
,
 6
6
 7
7
 8
8
1
/
8
100%