Paroi bactérienne et bêta-lactamines - iPubli

SYNTHÈSE
Ch de trava
Chargé de recherche l'Inse
ADRESSES -
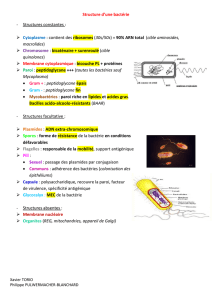
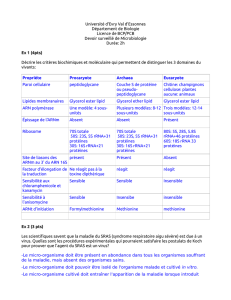
Paroi bactérienne
et bêta-lactamines
La structure de la paroi bactérienne est maintenant bien con
nue. Ses caractéristiques et propriétés dans différentes espè
ces bactériennes expliquent largement leur résistance ou sen
sibilité aux bêta-lactamines.
L

RÉFÉRENCES
U

1

RÉFÉRENCES

Figure
 6
6
 7
7
1
/
7
100%