Le cancer de l estomac héréditaire

LE G È N E D U M O I S
77
La Lettre du Cancérologue - Volume XIII - n° 2 - mars-avril 2004
RAPPEL ÉPIDÉMIOLOGIQUE
Au niveau mondial, le cancer de l’estomac reste le second can-
cer le plus fréquent, avec plus du 60 % des cas survenant dans
les pays en voie de développement. Avec près de 800 000 nou-
veaux cas par an, cette tumeur représente près de 10 % de tous
les nouveaux cas de cancer, ce qui la classe au second rang des
tumeurs après les cancers pulmonaires. Le cancer de l’estomac
est deux fois plus fréquent chez les hommes que chez les femmes.
L’incidence la plus élevée, avec 78 nouveaux cas par an pour
100 000 habitants, se retrouve chez les hommes au Japon, avec
également une incidence très élevée dans tout l’Est asiatique,
l’Amérique du Sud et l’Europe de l’Est. L’Europe de l’Ouest et
l’Amérique du Nord sont les moins touchées (1).
Dans les pays occidentaux, on note, ces cinquante dernières
années, une nette diminution de l’incidence des cancers de l’esto-
mac. Elle est surtout marquée pour les adénocarcinomes gas-
triques de type intestinal. Par conséquent, la fréquence relative
des autres types de cancer, comme les cancers gastriques diffus,
infiltrants ou peu différenciés, a augmenté (2, 3).
FACTEURS ÉTIOLOGIQUES
La pathogenèse du cancer de l’estomac est complexe. Parmi les
facteurs favorisants, on dénombre de nombreux facteurs diété-
tiques, comme une nutrition de pauvre qualité, avec des aliments
salés et fumés, et une haute teneur en nitrates. Une diminution
de la consommation de fruits et de légumes semble favorable, et
la consommation d’alcool favorisante (4). Le tabagisme joue un
rôle important, particulièrement pour les cancers de l’estomac sur-
venant à un âge jeune (5).
L’infection par l’Helicobacter pylori est un cofacteur important
du développement du cancer de l’estomac. Les patients porteurs
d’une infection chronique à H. pylori ont un risque doublé de
développer un cancer de l’estomac (6).
ALTÉRATIONS MOLÉCULAIRES DANS LA CARCINOGENÈSE
GASTRIQUE
Tous ces éléments ont été revus récemment par Roth (1). On
trouve des réarrangements des gènes TPR-MET, ce qui induit une
activation du proto-oncogène MET, ainsi que des altérations des
gènes K-ras, TP53 et APC, parfois une instabilité des microsa-
tellites (MSI) et une perte d’hétérozygotie du gène DCC (voir
références OMIM à la fin de l’article).
SYNDROME FAMILIAL
Des agrégations familiales de cancers de l’estomac ont été obser-
vées depuis très longtemps. En Italie, par exemple, on rapporte
qu’une agrégation familiale est présente dans jusqu’à 10 % des
cas de cancer de l’estomac (7, 8). Cependant, il est très difficile
d’imputer ces phénomènes d’agrégation familiale à une cause
génétique seule, puisque des facteurs environnementaux peuvent
très bien être partagés au sein d’une même famille ou d’une
m ê m e
région. Néanmoins, de nombreuses descriptions de familles
de
cancer de l’estomac, avec un mode de transmission autosomique
dominant, ont été publiées. C’est l’association avec le gène CDH1
qui a renouvelé l’intérêt pour cette entité diagnostique, qui a été
définie lors d’une Conférence de consensus tenue en juin 1999 à
Cambridge (9).
DÉFINITION DU CANCER DE L’ESTOMAC HÉRÉDITAIRE
Il s’agit d’un nouveau syndrome de cancers familiaux, hérité de
façon autosomique dominante et appelé “cancer gastrique diffus
héréditaire” (hereditary diffuse gastric cancer [HDGC]) ( 9 ) .
L’examen histologique des cancers de l’estomac liés à une muta-
tion de CDH1 a révélé un aspect diffus dans tous les cas. Depuis
plus de dix ans, on sait que ce type de cancer de l’estomac est lié
à des mutations somatiques du gène CDH1 codant pour la pro-
téine cadhérine E ( E - c a d h e r i n ) (10, 11). Récemment, chez les
patients porteurs d’une mutation de CDH1, on a identifié une
hyperméthylation du promoteur de CDH1 dans les tumeurs gas-
triques, montrant le rôle proéminent de la cadhérine E dans la
pathogenèse de ces cancers ( 1 2 ) . L’absence de cadhérine E
empêche l’adhésion intercellulaire et explique l’aspect diffus, à
cellules isolées, de ces cancers de l’estomac. On comprend
Le cancer de l’estomac héréditaire
Quelques éléments sur CDH1
Familial gastric cancer. Some news on CDH1
●
C. Monnerat*
* Centre pluridisciplinaire d’oncologie, département d’anatomopathologie,
Centre hospitalier universitaire vaudois, 1011 Lausanne, Suisse.

LE G È N E D U M O I S
78
La Lettre du Cancérologue - Volume XIII - n° 2 - mars-avril 2004
é g a lement que des cancers du sein de type lobulaire, caractérisés par
un aspect diffus à cellules isolées, aient aussi été décrits dans ces
familles ( 1 3 ) .
La distinction du type histologique diffus est essentielle pour
poser un diagnostic de cancer héréditaire de l’estomac. En effet,
des agrégations familiales de cancers de l’estomac d’un autre type
histologique ne constituent pas un critère diagnostique de ce syn-
dr o m e ( 9 ) . Un travail récent a montré qu’aucune mutation du gène
CDH1 n’est décelable dans les agrégations familiales compre-
nant un diagnostic histologique autre que celui des cancers gas-
triques diffus ( 1 4 ) .
Les cancers gastriques diffus héréditaires sont définis comme une
famille répondant aux critères suivants :
✓au moins deux cas de cancer gastrique diffus (prouvés histolo-
giquement) chez des apparentés du premier et/ou du second
d e gré, avec au moins un cas diagnostiqué avant l’âge de 50 ans ;
✓au moins trois cas de cancer gastrique diffus (prouvés histolo-
giquement) chez des apparentés du premier et/ou du second
degré, indépendamment de l’âge au moment du diagnostic.
Sur la base très limitée des familles documentées, on estime actuel-
lement que 25 % des familles répondant à ces critères vont pré-
senter une mutation germinale délétère du gène CDH1. D ’ a u t r e s
types de cancer, comme des cancers du sein lobulaire, des can-
cers colorectaux et des cancers de la prostate, ont été décrits chez
les porteurs d’une mutation du gène CDH1, mais il est trop tôt
pour inclure ces tumeurs dans les critères diagnostiques.
CDH1, DE LA DESCRIPTION DU GÈNE À CELLE DES FAMILLES
CDH1 est localisé sur le locus 16q22.1. Le promoteur de la cadhé-
rine E est sous le contrôle étroit de SNAI1. Des transfections de
SNAI1 sur plusieurs lignées cellulaires de cancers épithéliaux
ont montré une réduction importante de l’expression de la cadhé-
r i n e E et l’acquisition d’un phénotype de type fibroblaste ( 1 5 ) .
Le gène de CDH1 a été cloné en 1995 par Berx (13). Il comprend
1 6 exons, qui s’étendent sur une distance d’environ 100 kbp. La
structure de la protéine est semblable à celle des autres cadhé-
rines. Une réduction de l’expression de la cadhérine E est consi-
dérée comme un des éléments majeurs de la dysfonction de
l’adhésion intercellulaire, conduisant au processus d’invasion
tissulaire et de métastatisation à distance (11). Une perte d’expres-
s i o n de la cadhérine E a ainsi été démontrée pour les cancers gas-
t r i q u e s diffus, les cancers du sein lobulaires et certaines formes
de cancer du côlon (13). Guilford a été le premier à isoler des
mutations du gène CDH1 chez trois familles de cancer gastrique
diffus dans la population Maori de Nouvelle-Zélande ( 1 6 ) .
Parmi huit familles de cancer héréditaire de l’estomac en
Grande-Bretagne, Richards a identifié deux nouvelles mutations
de CDH1 dans deux familles. Ces deux mutations étaient prédic-
tives d’une protéine tronquée empêchant la fonction normale de
la cadhérine E (17). Gayther a analysé 18 familles d’origine
européenne avec une histoire familiale de cancer de l’estomac et
a identifié trois familles porteuses d’une mutation délétère de
CDH1. Aucune mutation n’a été découverte dans les familles
dont l’histologie était de type intestinal. L’âge d’apparition des
cancers était variable, et la pénétrance incomplète ( 1 8 ) .
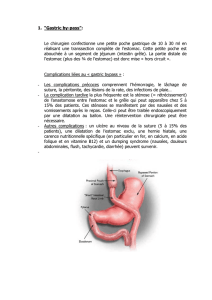
PRISE EN CHARGE CLINIQUE
La pénétrance de la maladie chez les porteurs d’une mutation de
CDH1 étant estimée à 70 % durant l’existence, et l’âge d’appari-
tion du cancer étant en moyenne de 38 ans (avec plusieurs cas rap-
portés entre 20 et 30 ans), une prophylaxie chirurgicale, similaire à
celle adoptée pour les cancers du sein et de l’ovaire héréditaires ou
les cancers médullaires de la thyroïde, a été envisagée (9). E n
effet, la surveillance endoscopique de ces cancers de l’estomac se
révèle difficile, puisque les cancers de l’estomac de type diffus se
manifestent souvent sous la forme d’une linite plastique sans alté-
ration de la muqueuse (9). La gastrectomie préventive est efficace,
mais grevée d’une morbidité élevée. On estime que la gastrectomie
prophylactique dans une population de jeunes adultes en bonne
santé causerait une mortalité de 1 à 2 % et une morbidité aiguë
majeure de 10 à 20 %, principalement en relation avec des pro-
blèmes d’anastomoses œsophagiennes. De plus, 100 % des
patients présenteront des complications à long terme en relation
avec un transit intestinal accéléré, des diarrhées, un dumping syn -
d r o m e et une perte de poids ( 9 ) . La gastrectomie préventive doit
être complète, afin d’enlever toute muqueuse à risque. Les
tranches de sections doivent donc emporter les limites entre l’esto-
mac et l’oesophage et entre l’estomac et le duodénum ( 9 ) . H u n t s-
man rapporte le devenir de deux familles atteintes d’un cancer gas-
trique diffus héréditaire rapporté précédemment par Gayther ( 1 9 ) .
Une gastrectomie préventive a été effectuée chez cinq porteurs
d’une mutation de CDH1 âgés de 22 à 40 ans. Une analyse micro-
scopique extensive des pièces opératoires a été effectuées. Dans
les cinq cas, des infiltrats de cellules malignes de type “en bague à
chaton” (signet ring cells) ont été identifiés. Dans trois cas, les
cancers gastriques diffus précoces étaient multifocaux, mais repré-
sentaient moins de 2 % de la muqueuse gastrique. Ces données
anatomopathologiques sont inquiétantes, et encouragent au dépis-
tage génétique des apparentés non atteints et à la proposition d’une
gastrectomie préventive. Ces patients devraient être référés, après
plusieurs conseils génétiques, dans un centre expérimenté de
chirurgie de l’estomac. Chez les porteurs d’une mutation ne sou-
haitant pas l’opération, une gastroscopie effectuée tous les six à
douze mois est indispensable, et ce dès l’âge de 20 ans au moins.
Les risques d’autres cancers, comme le cancer du sein ( 2 0 ) o u
celui du côlon ( 2 1 ) , doivent également être pris en charge par des
méthodes de dépistage adéquates (mammographie, colonoscopie)
( 9 ) . Il faut cependant reconnaître que cette entité diagnostique, le
“cancer héréditaire diffus de l’estomac”, est une pathologie rare,
puisque à ce jour seules 18 mutations du gène CDH1 ont été rap-
portées. De surcroît, seuls cinq cas de gastrectomie préventive ont
été publiés (22), et tous les cas de cancer diffus héréditaire de
l’estomac ne sont pas en relation avec une mutation de CDH1. Une
étude italienne n’a trouvé aucune mutation de ce gène chez les
1 1 patients atteints de cancer avec une agrégation familiale de cancers
de l’estomac diffus ( 2 3 ) . Des altérations complexes, comme des
anomalies de s p l i c e, sont vraisemblablement présentes. D’autres
gènes sont probablement en cause également. Il reste donc primor-
dial pour les cancérologues et les gastro-entérologues de connaître
ce nouveau syndrome, et de pouvoir référer ces familles dans les
centres d’oncogénétique appropriés. Seule l’étude de grandes
séries permettra de définir une prise en charge adéquate et sûre.
■

LE G È N E D U M O I S
R
É F É R E N C E S B I B L I O G R A P H I Q U E S
1.
Roth AD. Curative treatment of gastric cancer : towards a multidisciplinary
approach ? Crit Rev Oncol Hematol 2003;46,1:59-100.
2.
Correa, P. The epidemiology of gastric cancer. World J Surg 1991;15,2: 228-34.
3 .
Pinheiro PS, van der Heijden LH, Coebergh JW. Unchanged survival of
gastric cancer in the southeastern Netherlands since 1982 : result of differen -
tial trends in incidence according to Lauren type and subsite. Int J Cancer
1999;84,1:28-32.
4.
Neugut AI, Hayek M, Howe G. Epidemiology of gastric cancer. Semin Oncol
1996;23,3:281-91.
5 .
Coggon D, Osmond C, Barker DJ. Stomach cancer and migration within
England and Wales. Br J Cancer 1990;61,4:573-4.
6.
Nyren O. Is Helicobacter pylori really the cause of gastric cancer ? Semin
Cancer Biol 1998;8,4:275-83.
7.
La Vecchia C et al. Family history and the risk of stomach and colorectal
cancer. Cancer 1992;70,1:50-5.
8.
Zanghieri G et al. Familial occurrence of gastric cancer in the 2-year expe -
rience of a population-based registry. Cancer 1990;66,9:2047-51.
9.
Caldas C et al. Familial gastric cancer : overview and guidelines for mana -
gement. J Med Genet 1999;36,12:873-80.
1 0 .
Machado JC et al. E-cadherin gene mutations provide a genetic basis
for the phenotypic divergence of mixed gastric carcinomas. Lab Invest
1999;79,4:459-65.
11.
Becker KF et al. E-cadherin gene mutations provide clues to diffuse type
gastric carcinomas. Cancer Res 1994;54,14:3845-52.
1 2 .
Machado JC et al. E-cadherin gene (CDH1) promoter methylation as
th e second hit in sporadic diffuse gastric carcinoma. Oncogene
2 0 0 1 ; 2 0 , 1 2 : 1 5 2 5 - 8 .
13.
Berx G et al. E-cadherin is a tumour/invasion suppressor gene mutated in
human lobular breast cancers. Embo J 1995;14,24:6107-15.
14.
Oliveira C et al. Screening E-cadherin in gastric cancer families reveals
germline mutations only in hereditary diffuse gastric cancer kindred. Hum
Mutat 2002;19,5:510-7.
15.
Cano A et al. The transcription factor snail controls epithelial-mesenchy -
mal transitions by repressing E-cadherin expression. Nat Cell Biol
2000;2,2:76-83.
16.
Guilford P et al. E-cadherin germline mutations in familial gastric cancer.
Nature 1998;392,6674:402-5.
17.
Richards FM et al. Germline E-cadherin gene (CDH1) mutations predis -
pose to familial gastric cancer and colorectal cancer. Hum Mol Genet
1999;8,4:607-10.
18.
Gayther SA et al. Identification of germline E-cadherin mutations in gas -
tric cancer families of European origin. Cancer Res 1998;58,18:4086-9.
19.
Huntsman DG et al. Early gastric cancer in young, asymptomatic carriers
of germline E-cadherin mutations. N Engl J Med 2001;344,25:1904-9.
2 0 .
Pharoah PD, Guilford P, Caldas C. Incidence of gastric cancer and
breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse
gastric cancer families. Gastroenterology 2001;121,6:1348-53.
21.
Salahshor S et al. A germline E-cadherin mutation in a family with gastric
and colon cancer. Int J Mol Med 2001;8,4:439-43.
2 2 .
Schwarz A. Preventive gastrectomy in patients with gastric cancer risk
due to genetic alterations of the E-cadherin gene defect. Langenbecks Arch
Surg 2003;388,1:27-32.
2 3 .
Graziano F, et al. Screening E-cadherin germline mutations
in Italian patients with familial diffuse gastric cancer : an analysis in
th e Di s tr ic t of Ur bi no, R egion Marche , Ce ntr a l I tal y. Tu m ori
2 0 0 3 ; 8 9 , 3 : 2 5 5 - 8 .
INFORMATIONS DISPONIBLES SUR INTERNET
Numéro d’accès et liens contenus dans cet article :
Online Mendelian Inheritance in Man (OMIM) :
http://www3.ncbi.nlm.nih.gov/entrez/query.fcgi?db=OMIM&cmd=Limits
✓APC (OMIM 175100 adenomatous polyposis of the colon)
✓CDH1 (OMIM 192090 cadherin 1)
✓DCC (OMIM 120470 Deleted in colorectal carcinoma)
✓GASTRIC CANCER (OMIM 137215)
✓HNPCC (MSI) (OMIM 114500 colorectal cancer, hereditary
nonpolyposis)
✓KRAS2 (OMIM 190070 V-KI-RAS2 kirsten rat sarcoma
2 viral oncogene homolog)
✓MET (OMIM 164860 met protooncogene)
✓SNAI1 (OMIM 604238 SNAIL 1, drosophila, homolog of)
✓TP53 (OMIM 191170 tumor protein p53)
✓TPR (OMIM 189940 translocated promoter region)
Merci d’écrire nom et adresse en lettres majuscules
❏Collectivité .................................................................................
à l’attention de ..............................................................................
❏Particulier ou étudiant
M., Mme, Mlle ................................................................................
Prénom ..........................................................................................
Pratique : ❏hospitalière ❏libérale ❏autre ...........................
Adresse e-mail ...............................................................................
Adresse postale .............................................................................
......................................................................................................
Code postal ........................Ville ……………………………………
Pays................................................................................................
Tél..................................................................................................
Merci de joindre votre dernière étiquette-adresse en cas de réabonnement,
changement d’adresse ou demande de renseignements.
Total à régler .......... E
À découper ou à photocopier
✂
ABONNEMENT : 1 an
+
ET POUR 10 EDE PLUS !
10
E
, accès illimité aux 22 revues de notre groupe de presse disponibles sur notre
site vivactis-media.com (adresse e-mail gratuite)
+
❐10
E
avec un abonnement ou un réabonnement
MODE DE PAIEMENT
❐
carte Visa, Eurocard Mastercard
N°
Signature :Date d’expiration
❐
chèque
(à établir à l'ordre de La Lettre du Cancérologue)
❐
virement bancaire à réception de facture
(réservé aux collectivités)
EDIMARK SAS - 62-64, rue Jean-Jaurès - 92800 Puteaux
T é l . : 01 41 45 80 00 - Fax : 01 41 45 80 25 - E-mail : contacts@vivactis-media.com
❐120
Ecollectivités
❐100
Eparticuliers
❐70
Eétudiants*
*joindre la photocopie de la carte
❐100
Ecollectivités
❐80
Eparticuliers
❐50
Eétudiants*
*joindre la photocopie de la carte
ÉTRANGER (AUTRE QU’EUROPE)
FRANCE/DOM-TOM/EUROPE
❐
1
/
3
100%