Le West Nile virus en pédiatrie

Dossier
mt pédiatrie 2012 ; 15 (2) : 79-84
Le West Nile virus en pédiatrie
West Nile Virus status in infants
Gaël Guyon
Michel Maestracci
Service des Urgences pédiatriques,
Hôpital Lapeyronie, 371 avenue du
Doyen Gaston Giraud, 34295
Montpellier Cedex 5, France
<g-guyon@chu-montpellier.fr>
Résumé. Arbovirose transmise de fac¸on indirecte à l’homme par la piqûre d’un arthropode
hématophage vecteur, l’infection à virus West Nile (virus du Nil occidental) atteint plus fré-
quemment les populations adultes que pédiatriques mais les caractéristiques épidémiologiques
et cliniques sont proches avec une majorité de formes asymptomatiques ou fébriles isolées et
une proportion mineure de tableaux neuro-invasifs. La circulation virale, faible en France,
tend à progresser aux ´
Etats-Unis et en Europe. En l’absence de thérapeutique spécifique effi-
cace, tous les moyens de prévention apparaissent comme les meilleurs outils de lutte contre
la diffusion du virus.
Mots clés : zoonose, West Nile (virus du Nil occidental), arbovirose, méningite
Abstract. West Nile Virus is an arbovirus accidentally transmitted to humans from an aviary
reservoir via an infected mosquito. West Nile Virus infection affects mostly the adults popula-
tion than children but the epidemiological features and clinical manifestations are nearly the
same in the two populations. The majority of West Nile Virus infections are asymptomatic or
isolated febrile illness with a minority of neuroinvasive cases. The viral circulation in France
is mild but is tending to progress in Europe and the United States. In the absence of specific
terapy, the preventive measures are the best tools to fight the proliferation of the virus.
Key words: zoonosis, West Nile virus, arbovirosis, meningitis
La découverte du virus West Nile
(WNV/virus du Nil occidental)
est relativement récente, estimée à
l’an 1937 en Ouganda par son isole-
ment dans le sérum d’une jeune
femme fébrile vivant dans le dis-
trict du West Nile [1]. Malgré tout,
on estime a posteriori que sa circu-
lation est beaucoup plus ancienne
[2]. Initialement décrite à l’occasion
d’épidémies de taille et de gravité
variables, la circulation du West Nile
virus (WNV) s’est progressivement
étendue pour devenir cosmopolite
avec de plus en plus de zones endé-
miques. En raison de sa très faible
circulation sur le sol franc¸ais, la
population reste naïve vis-à-vis de
ce virus et toute émergence risque
de provoquer une épidémie poten-
tiellement dangereuse. Il convient en
période à haut risque à cause de
l’amplification de la circulation virale
(existence en forte densité du mous-
tique vecteur et de la population
aviaire réservoir viral), de s’informer
de la présence du virus dans la popu-
lation animale (équine en particulier)
et d’évoquer l’infection à WNV en
cas de situations cliniques fébriles
inexpliquées.
Épidémiologie
L’arrivée du WNV en France date
des années 1962-1963 en Camargue
[3] où se sont déclarées une épidé-
mie équine touchant 500 chevaux
avec 10 % de décès et une atteinte
simultanée de 13 personnes dont
6 formes neuro-invasives (méningo-
encéphalites) avec un décès. Après
une période silencieuse de 35 ans, le
WNV est réapparu sur le sol franc¸ais
d’abord par le biais d’une épidé-
mie équine de 141 cas (dont 76
formes invasives et 21 décès), puis
par la survenue de 7 cas humains
dans le Var sous 3 formes neuro-
logiques. Depuis cette date, aucun
cas humain confirmé n’a été rapporté
malgré le signalement aux dispositifs
de surveillance de plusieurs cas sus-
pects [4]. En revanche, des cas équins
sont périodiquement rapportés sans
réelle épidémie (1 022 entre 2000
et 2010). L’infection à WNV a été
responsable de plusieurs épidémies
notables depuis le XXe siècle : en
Israël dans les années 1950, au
Moyen-Orient, en Afrique du Sud et
de l’Est mais beaucoup plus proches
de nous en Roumanie en 1996
doi:10.1684/mtp.2012.0422
mtp
Tirés à part : G. Guyon
79
Pour citer cet article : Guyon G, Maestracci M. Le West Nile virus en pédiatrie. mt pédiatrie 2012 ; 15(2) : 79-84 doi:10.1684/mtp.2012.0422
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Le West Nile virus en pédiatrie
(835 cas dont 17 décès) ou en Russie en 1999 avec une
épidémie touchant 836 personnes et responsable de 17
décès. Les États-Unis sont restés préservés jusqu’en 1999
où s’est déclarée une épidémie dans la région de New
York faisant 7 morts. Rapidement l’infection s’est propagée
d’abord sur l’est des États-Unis puisqu’en 2 ans, on recen-
sait déjà plus de 3 000 cas graves [5]. Depuis, l’épidémie
s’est répandue sur la totalité du territoire et entre jan-
vier 2010 et le 1er novembre 2011, le Center for Control
Disease a recensé 1 600 cas [5] dont 64 % de formes
invasives. Depuis l’émergence du virus sur le sol améri-
cain, l’infection y a causé plus de 1 000 décès. Ces chiffres
sont sans doute très sous-estimés au vu de la propension à
déclarer plus spontanément les cas graves et de l’absence
de détection des patients asymptomatiques ou présentant
des formes cliniques bénignes. En Europe également le
WNV circule abondamment avec un déplacement pro-
gressif vers l’Ouest en particulier depuis l’année 2010
qui a vu l’apparition des premiers cas humains en Alba-
nie, en Turquie, en Italie [6] et surtout en Grèce avec un
nombre de cas significatifs (262 cas avec 17 % de morta-
lité) et l’extension rapide de l’épidémie sur tout le territoire
[7, 8]. Une épidémie à grande échelle constitue souvent
le point de départ de l’implantation du virus dans le pays
concerné. Sachant que le virus et ses différents hôtes ne
connaissent pas de frontières, et compte tenu des ten-
dances actuelles de circulation virale, il est à craindre que
le WNV ne se fixe prochainement sur le sol franc¸ais de
fac¸on durable.
Écologie
Les infections à WNV sont des arboviroses, patholo-
gies à transmission vectorielle. Les effets sur l’homme ont
été réellement précisés dans les années 1950 en même
temps que la description de l’écosystème adapté au virus
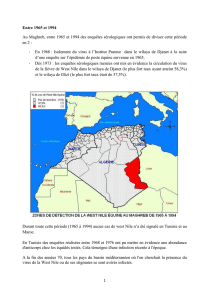
et à sa circulation. La propagation de la maladie résulte
de la transmission indirecte du virus d’un hôte vertébré
à un autre par l’intermédiaire d’un insecte hématophage
arthropode (figure 1). Le vecteur principal de l’infection
à WNV est le moustique femelle, tout particulièrement
le genre Culex (modestus, pipiens, restuans, etc.) mais
aussi moins fréquemment certains Aedes (vexans, japo-
nicus, etc.) [9]. D’autres vecteurs peuvent être également
impliqués de fac¸on plus épisodique, il s’agit des tiques
ou des punaises. Le moustique s’infecte habituellement
à partir d’un hôte virémique (en général un oiseau) et
devient alors vecteur du virus. Il peut à l’occasion d’une
nouvelle piqûre transmettre le virus à d’autres hôtes ver-
tébrés (y compris aux oiseaux) sous réserve que se soit
produite une phase complète d’amplification virale au
sein du moustique. La contamination humaine ou équine
n’est donc qu’accidentelle et représente une impasse épi-
démiologique en raison de la faible virémie chez ces
deux hôtes empêchant la réinfestation du vecteur. D’autres
vertébrés peuvent être concernés par l’infection à WNV,
il s’agit de l’écureuil, du lapin, du chien, du raton-
laveur, de la chauve-souris. Les oiseaux constituent le
principal réservoir du virus et favorisent également avec
le moustique l’amplification virale grâce à une virémie
durable et élevée permettant un taux de reproduction
élevé. Plus de 300 espèces d’oiseaux ont été recensées
[10], notamment plusieurs variétés d’oiseaux migrateurs
qui favorisent la mondialisation de la circulation virale.
Même si l’oiseau infecté reste habituellement indemne,
des formes symptomatiques sont possibles et l’infection à
WNV est déjà aux États-Unis responsable du déclin de
certaines espèces aviaires [10]. Pour les autres espèces
animales, la description clinique est surtout bien connue
pour les chevaux. L’infection reste le plus souvent inap-
parente mais les formes symptomatiques (essentiellement
neurologiques) sont par contre presque toujours sévères
avec un taux de mortalité conséquent. La dernière épi-
démie équine franc¸aise par exemple avait fait 141 cas et
21 décès en 2000. C’est d’ailleurs à partir de cette épi-
démie équine, confrontée aux données épidémiologiques
internationales, en particulier américaine, qu’a été mis en
place un dispositif de surveillance sur le territoire franc¸ais.
Surveillance
Ce dispositif de surveillance est mixte comportant une
surveillance humaine, entomologique, équine et aviaire.
Après 7 ans de recul, la capacité de détection précoce
de la circulation virale est efficiente [11] et au vu de la
faible circulation du WNV sur le sol franc¸ais, le disposi-
tif, qui concerne 9 départements du bassin méditerranéen,
n’est depuis 2009 activé que de début juin à fin octobre
de chaque année. Cette période de 5 mois correspond à
la période la plus à risque puisque les vecteurs sont en
densité élevée, les oiseaux migrateurs sont sur place ou
circulent et les conditions climatiques sont favorables. Ce
dispositif comporte 4 volets. Le volet humain concerne
particulièrement l’adulte et consiste en la détection des
cas humains, en particulier des formes neuro-invasives par
le biais de la réalisation d’examens complémentaires spé-
cifiques (recherche d’ARN viral, culture, sérologie) devant
toute situation clinique correspondant à une définition
de cas telle qu’édictée par le dispositif de surveillance :
tout adulte ≥15 ans présentant dans l’un des 9 dépar-
tements, pendant la période à risque un état fébrile avec
des manifestations neurologiques ayant imposé la réalisa-
tion d’une ponction lombaire [4]. Les cas suspects sont
déclarés aux Agences régionales de santé et aux Cellules
80 mt pédiatrie, vol. 15, n◦2, avril-mai-juin 2012
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Transmission
interaviaire
possible
Cycle
de transmission
habituel
Mammifères :
impasse
épidémiologique
1
2
3
Figure 1. Cycle de réplication virale.
interrégionales d’épidémiologie. Le volet équin du dis-
positif de surveillance repose sur la déclaration des cas
d’encéphalite équine par la DGAL (Direction générale de
l’alimentation). Le volet entomologique est géré par l’EID
(Entente interdépartementale de la démoustication) qui est
chargée du recensement des populations de moustique.
Le volet aviaire, en latence depuis 2008 est susceptible
d’être réactivé à tout moment en cas de réapparition de la
circulation virale.
Plusieurs autres pays ont mis en place de tels dispositifs
en raison de l’augmentation de la présence du virus sur
leur territoire (Grèce, Italie, États-Unis).
Pathogénie
Le WNV ou virus du Nil Occidental est un arbo-
virus (terme dérivé de l’appellation anglaise arthropod
borne virus), il appartient au genre des flavivirus de la
famille des flaviridae et possède une structure antigénique
proche de celle du virus de l’encéphalite japonaise (EJV)
ou du virus de l’encéphalite de Saint-Louis ; il s’agit
d’un virus enveloppé, à ARN comportant une extrémité
5’ codant pour des protéines de structure (capside, mem-
brane et enveloppe) dont certaines seraient impliquées
dans les mécanismes d’invasion du système nerveux cen-
tral [12] et une extrémité 3’ codant pour des protéines non
structurales de type enzymatique (polymérase, hélicase,
protéase, etc.), principales cibles actuelles des recherches
vaccinales.
Après une piqûre infectante, le WNV gagne les kéra-
tinocytes et les cellules de Langerhans qui vont migrer en
direction des sites lymphoïdes loco-régionaux, premier
site de réplication virale. Dans un deuxième temps, le
virus diffuse par voie systémique en direction des organes
profonds tels que rein et rate, seconds sites potentiels
de réplication virale. Selon l’importance de la virémie,
le virus peut franchir la barrière hémato-méningée et
être responsable des atteintes neuro-invasives [13]. Cette
pathogénie est assez similaire à celle des autres virus à
tropisme neurologique.
Clinique
La prévalence de l’infection en pédiatrie est faible,
et jusqu’à récemment, les éléments cliniques dont nous
disposions relevaient de petites séries éparses à travers
le monde. En 2009, l’équipe de Lindsey [14] a repris 9
ans de cas d’infections pédiatriques à WNV soit 1478 cas
mt pédiatrie, vol. 15, n◦2, avril-mai-juin 2012 81
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Le West Nile virus en pédiatrie
permettant une analyse clinique plus fine des formes de
l’enfant. Ces formes pédiatriques de la maladie repré-
sentent en zone endémique5%dunombre global de
cas déclarés sur la même période aux États-Unis. Contrai-
rement à une série soudanaise [15] où la totalité des cas
étaient survenus chez l’enfant, notamment de moins de 5
ans, cette fréquence pédiatrique est celle classiquement
retenue dans la littérature. La sévérité des infections à
WNV est moindre chez l’enfant (et l’adulte jeune) [14, 16]
et la durée d’évolution paraît plus courte [16]. Les enfants
contaminés restent le plus souvent pauci ou asymptoma-
tique [16].
La présentation clinique habituelle des cas sympto-
matiques survient après une phase d’incubation de durée
variable entre 3 et 15 jours et associe fièvre, céphalées,
myalgies et asthénie importante à la manière d’un syn-
drome grippal avec parfois éruption cutanée aspécifique
ou manifestations digestives modérées [14, 17, 18]. Les
formes sévères ou neuro-invasives représentent un faible
pourcentage rapporté au nombre supposé de cas mais près
de 30 % des formes cliniquement apparentes (i.d. adultes
jeunes) contre près de 50 % des cas pour les adultes de plus
de 50 ans [14]. Il s’agit surtout de méningites lymphocy-
taires, de méningo-encéphalites ou d’atteintes de la corne
antérieure de la moelle [14, 16, 17, 19, 20]. L’évolution
de ces formes graves est le plus souvent favorable mais de
fac¸on ponctuelle peuvent persister des séquelles neurolo-
giques parfois extrêmement graves [19, 21, 22]. D’autres
modes de présentation plus atypiques sont rapportés dans
la littérature : hépatite fulminante, atteinte chorioréti-
nienne, atteinte myocardique [23].
Malgré ces atteintes neuro-méningées ou systémiques,
la létalité reste faible en pédiatrie atteignant entre 1 et 3 %
des formes symptomatiques.
Nombre d’infections pédiatriques à WNV surviennent
sur une population immunocompétente. Il semble
toutefois que certains éléments puissent influer signi-
ficativement sur le risque de développer une forme
neuro-invasive, en particulier l’immunosuppression [18],
l’âge >10 ans [14] ou l’arrivée du virus sur une popula-
tion naïve [24]. D’autres facteurs de risque liés au virus
lui-même ou à l’hôte sont probablement en cause.
En sus de la contamination habituelle et accidentelle
du WNV de l’enfant par le biais d’une piqûre d’arthropode
hématophage et ornithophile, d’autres mécanismes de
transmission ont été établis mais demeurent minoritaires.
Le passage transplacentaire du WNV a été évoqué à partir
de la mise en évidence d’anticorps sur plusieurs prélè-
vements de sang du cordon de nouveau-nés de mères
contaminées en cours de grossesse [25]. L’existence d’une
virémie même brève rend la transmission horizontale par
le biais de transfusions ou de greffes d’organes envisa-
geable et un sérodépistage est obligatoire dans plusieurs
pays (États-Unis, Italie) à haute circulation virale avant tout
don de sang ou d’organes [6, 20]. La transmission par
l’allaitement maternel a également été suspectée à partir
d’un cas mais la surveillance systématique mise en place
depuis n’a pas permis de confirmer ce mode de contami-
nation [26].
Au final, l’infection pédiatrique à WNV apparaît
similaire à celle de l’adulte jeune mais moins sévère
que chez l’adulte plus âgé. Sa fréquence est faible et
augmente progressivement avec l’âge. Si la méningite lym-
phocytaire reste l’atteinte neuro-invasive prédominante,
d’autres manifestations plus graves peuvent exister. La
durée d’évolution de l’infection pédiatrique semble plus
courte que chez l’adulte.
Diagnostic
L’identification virologique est surtout importante en
cas d’atteinte neuro-invasive ou de forme clinique sévère.
La virémie est très brève (à peine quelques jours) dans
l’espèce humaine ce qui freine la mise en évidence directe
du génome viral par technique de Reverse Transcriptase
Polymerase Chain Reaction (RT-PCR) à partir d’un échan-
tillon de sérum puisque le matériel viral a disparu quand
les signes cliniques apparaissent. Cette RT-PCR garde tou-
tefois tout son intérêt à partir du LCR. En l’absence de
cet outil de référence, le diagnostic repose encore sur les
méthodes sérologiques à partir du sang ou du LCR. La sen-
sibilité de la sérologie reste insuffisante, variant de 70 à
90 % en fonction de l’instant du prélèvement par rapport
à la phase de virémie et des réactions croisées peuvent
exister avec d’autres flavivirus en particulier le virus de la
fièvre jaune ou l’EJV. L’isolement direct du virus par culture
virale est possible mais celle-ci est lente (plusieurs jours)
et reste réservée à des laboratoires de type P3.
En cas de formes cliniques invasives, les patients
peuvent également présenter de fac¸on tout à fait aspé-
cifique des troubles hydro-électrolytiques variés, des
anomalies de l’imagerie cérébrale et du LCR (formule
panachée et légère élévation du taux de protéine) en cas
d’atteinte de type méningo-encéphalitique [16].
Globalement les bilans biologiques «classiques »ne
permettent de faire aucune distinction entre une infection
à WNV et toute autre pathologie virale. Dans les pays où la
circulation virale est importante, du fait de cette absence
de méthode diagnostique spécifique et de la fréquence
élevée de formes fébriles pures ou asymptomatiques, le
nombre réel de cas est probablement très sous-estimé.
Traitement
À ce jour, aucune thérapeutique spécifique d’espèce
n’est disponible. Sont en cours d’élaboration des trai-
tements à base d’anticorps monoclonaux dirigés contre
des protéines non structurales du virus de type NS dont
82 mt pédiatrie, vol. 15, n◦2, avril-mai-juin 2012
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

l’utilisation chez la souris a montré une protection croisée
avec le virus de l’encéphalite japonaise [27]. Ces traite-
ments restent expérimentaux et en pratique de terrain, la
prise en charge est purement symptomatique comportant
des mesures de réanimation, d’assistance ventilatoire et
de correction des troubles hydro-électrolytiques en cas de
formes neuro-invasives. Les antiviraux tels que la ribavirine
ou ses analogues structuraux ont été testés sur des popula-
tions d’adultes et n’ont pas démontré d’effets significatifs
sur la réduction de morbi-mortalité en dépit d’utilisation
de fortes posologies (jusqu’à 60 mg/kg/j) [28–30]. D’autres
traitements ont été proposés in vivo tels que des perfu-
sions d’immunoglobulines polyvalentes ou in vitro avec
des inhibiteurs enzymatiques du cycle de réplication virale
[31], ou des bloqueurs des protéines non structurales
d’espèce. Les données d’efficacité restent très en dec¸à des
objectifs, néanmoins tous ces travaux constituent autant
de voies de recherche pour le développement de vaccin
spécifique humain.
Prévention
De fac¸on générale, l’émergence globale de toutes les
pathologies liées aux flavivirus, en l’absence de thérapeu-
tique antivirale spécifique et en raison de la circulation
active des vecteurs ainsi que des réservoirs viraux, posi-
tionne la politique de prévention au premier plan. Celle-ci
doit être basée sur plusieurs axes : la lutte antivectorielle,
l’amélioration des méthodes de diagnostic, la prévention
verticale et le développement de vaccins en médecine
humaine et vétérinaire.
La vaccination humaine n’est pas disponible actuelle-
ment même si des essais thérapeutiques prometteurs sont
en cours avec un vaccin chimérique permettant une séro-
conversion durable après plusieurs mois de recul [32].
Les approches récentes sur les protéines non structurales
du WNV de type NS1 ont permis outre la production
d’anticorps monoclonaux [27] d’ouvrir la voie à d’autres
cibles pour la recherche vaccinale. Un vaccin vivant atté-
nué est en cours d’élaboration à partir de modifications de
structures sur ces protéines de type NS [33].
Parallèlement la vaccination équine, disponible dans
certains pays européens ou aux États-Unis [34] a mon-
tré une réelle efficacité dans la prévention de la
morbi-mortalité équine mais la situation épidémiologique
franc¸aise ne justifie pas à ce jour son utilisation de routine.
La lutte contre l’invasion vectorielle est donc primor-
diale. Elle est mixte à la fois individuelle, par l’utilisation
de répulsifs adaptés sur les vêtements et la peau (à base
de DEET notamment [5], par le port de manches longues
après le coucher du soleil, et collective par des pro-
grammes de démoustication dont certains à large échelle
sont déjà en place dans les zones de forte endémie, par la
lutte contre les zones d’eau stagnante propices à la repro-
duction du moustique. Malheureusement, ces mesures
essentielles en termes d’impact de santé publique, présent
et à venir, se heurtent au manque de volonté politique et
de ressources.
Plusieurs pays ont inscrit dans le cadre de plan national
de surveillance le dépistage sérologique lors des dons de
sang, de lait et d’organe afin de réduire le risque de trans-
mission verticale [6]. Celui-ci ne trouve également pas de
légitimité en France au vu de l’épidémiologie actuelle.
Aucune infection pédiatrique n’a encore été recen-
sée à ce jour en France et les derniers cas humains
datent de 2003. Malgré tout la dissémination rapide et
l’implantation durable du WNV dans d’autres pays euro-
péens sont assez d’arguments pour craindre son arrivée
prochaine sur le sol franc¸ais. L’absence de thérapeu-
tique spécifique ou de vaccination efficace chez l’homme
(d’autant plus que la génétique virale évolue et que le vac-
cin n’aura sans doute qu’une efficacité limitée à quelques
sérotypes) doit inciter à une lutte active anti-vectorielle au
vu des données cliniques disponibles outre-Atlantique et
du risque d’atteinte neuro-invasive en pédiatrie.
Références
1. Smithburn KC, Hughes TP, Burke AW, et al. A neurotropic virus
isolated from the blood of a native of Uganda.AmJTropMedHyg
1940 ; 20 : 471-92.
2. Marr JS, Calisher CH. Alexander the Great and West Nile virus
encephalitis. Emerg Infect Dis 2003;9:1599-603.
3. Hannoun C, Panthier R, Mouchet J, et al. Isolation in France of the
West Nile virus from patients and from the vector Culex modestus
ficalbi. CR Hebd Seances Acad Sci 1964 ; 259 : 4170-2.
4. Institut National de Veille Sanitaire. Dossier thématique West Nile
Virus. Juil 2011.
5. Center for Disease Control and Prevention. West Nile Virus Statis-
tics, Surveillance and Control Case Count, nov 2011.
6. Barzon L, Pacenti M, Cusinato R, et al. Human cases of West Nile
Virus Infection in north-eastern Italy, 15 June to 15 November 2010.
Euro Surveill 2011 ; 16 : pii 19949. http://www.eurosurveillance.org/
ViewArticle.aspx?ArticleId=19949.
7. Danis K, Papa A, Papanikolaou E, et al. Ongoing outbreak of West
Nile virus infection in humans, Greece, July to August 2011. Euro
Surveill. 2011 aug 25 ; 16. pii 19951. http://www.eurosurveillance.
org/ViewArticle.aspx?ArticleId=19951..
8. Danis K, Papa A, Theocharopoulos G, et al. Outbreak of West Nile
virus infection in Greece, 2010. Emerg Infect Dis 2011 ; 17 : 1868-72.
9. Chuang TW, Knepper RG, Stanuszek WW, Walker ED, Wilson
ML. Temporal and spatial patterns of West Nile virus transmis-
sion in Saginaw County, Michigan, 2003-2006. J Med Entomol
2011 ; 48 : 1047-56.
10. Hofmeister EK. West Nile virus : North American experience.
Integr Zool 2011;6:279-89.
mt pédiatrie, vol. 15, n◦2, avril-mai-juin 2012 83
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
1
/
6
100%