Les atomes Chapitre 5

Chapitre 5
Les atomes
Nous avons vu lors du chapitre précédant que la masse se conserve lors d'une transformation chimique. Pourtant les
réactifs sont différents des produits, les molécules ne sont pas les mêmes. Pour comprendre les transformations
chimiques, il faut introduire une nouvelle notion : l'atome.
I : Symboles d'atomes et formules de molécules
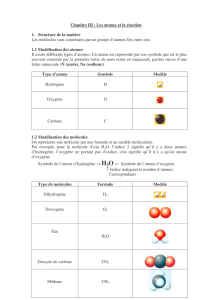
Les molécules sont faites de plus petites particules appelés atomes qui sont liés entre eux.
➔Les atomes : il existe 118 atomes différents symbolisés par une ou plusieurs lettres dont voici quelques
exemples :
Nom Carbone Oxygène Hydrogène Azote Fer Cuivre Soufre Argent Or
Symbole C O H N Fe Cu S Ag Au
➔Les molécules sont des combinaisons d'atomes que l'on représente avec des formules :
Nom Dioxyde de
carbone Dioxygène Dihydrogène Eau Monoxyde
de carbone Méthane Butane Chlorure
d'hydrogène
Formule CO2O2H2H2O CO CH4C4H10 HCl
Attention : le numéro se rapporte toujours à l'atome qui le précède. Par exemple, la formule H2O signifie qu'il y a 2
atomes d'hydrogène et 1 atome d'oxygène (l'indice 1 n'est jamais représenté). Dans la formule CO2, il y a 1 atome
de carbone et deux atomes d'oxygène.
Applications :
donne le nombre d'atomes ainsi que la composition des molécules suivantes : C3H8 (propane), Fe3O4
(oxyde de fer), C2H6O (éthanol), CuSO4 (sulfate de cuivre), NH4NO3 (nitrate d'ammonium)
II : Equations de réactions chimiques
On étudie la combustion du carbone :
Bilan de la transformation
chimique
Carbone + dioxygène →dioxyde de carbone
Equation de réaction C+ O2→ CO2
Nombre d'atomes 1 carbone et 2 oxygène → 1 carbone et 2 oxygène
Conclusion : Les atomes présents dans les réactifs sont de même nature en même nombre que les atomes présents
dans les réactifs.
Pour respecter cette règle, il faut donc équilibrer les équations :
Par exemple, pour la combustion complète du méthane, on a :
Bilan de la transformation
chimique
méthane + dioxygène →eau + dioxyde de carbone
Equation de réaction CH4+ O2→H2O+ CO2
Nombre d'atomes 1 carbone, 4 hydrogène, 2 oxygène → 1 carbone, 2 hydrogène, 3 oxygène
On ajoute alors des molécules à dans les produits ou les réactifs pour obtenir le même nombre de chaque coté :
Equation de réaction CH4+ 2 O2→2 H2O+ CO2
Nombre d'atomes 1 carbone, 4 hydrogène, 2x2 oxygène → 1 carbone, 2x2 hydrogène, (2x1)+2 oxygène
1 carbone, 4 hydrogène, 4 oxygène → 1 carbone, 4 hydrogène, 4 oxygène
Chimie Chapitre 5 : Les atomes – Page 1/1
1
/
1
100%