Activation des intégrines et adhérence des leucocytes et des

Revue
Activation des intégrines et adhérence
des leucocytes et des plaquettes
Nouvelles données sur des voies
de signalisation communes
Leukocyte and platelet integrin activation and adhesion
New data on common signaling pathways
Mohamed Bouaouina
Lise Halbwachs-Mecarelli
INSERM U507, Hôpital Necker,
161 rue de Sèvres, 75015 Paris
<mecarelli@necker.fr>
Résumé.Une caractéristique des leucocytes et des plaquettes est leur passage très
rapide de l’état circulant à l’état adhérent, sous l’effet de stimuli inflammatoires ou
thrombotiques. Ce passage se fait grâce aux intégrines, qui changent de conforma-
tion pour acquérir une affinité pour des substrats d’adhérence. Des signalisations
complexes, dites signalisation inside-out conduisent ainsi à l’activation des intégri-
nes b2 dans les leucocytes et de l’intégrine aIIbb3 dans les plaquettes. Les patients
ayant un déficit d’adhérence leucocytaire de type III (LAD-III ou variants LAD-1)
souffrent d’infections sévères et de saignements, dus à un défaut de signalisation
inside-out se traduisant par un défaut d’activation des intégrines sur les leucocytes
et les plaquettes. Ce déficit d’adhérence révèle ainsi l’existence d’éléments
communs de signalisation inside-out d’activation des intégrines des cellules du
système hématopoïétique. Cette revue, centrée sur les intégrines b2 du neutrophile
et aIIbb3 des plaquettes, donne la vision actuelle que l’on peut avoir de la structure
de ces intégrines et de leurs changements vers une conformation de forte affinité
pour leurs ligands. L’ensemble des fonctions des neutrophiles et des plaquettes
faisant intervenir les intégrines est détaillée. La dernière partie rapporte les
données les plus récentes concernant les voies de signalisation inside-out, déclen-
chées par différents stimuli dans les cellules hématopoïétiques, pour en souligner
les points communs.
Mots clés : neutrophile, plaquette, intégrine, adhérence, LAD
Abstract.A peculiar feature of leukocytes and platelets is their rapid switching from
a circulating to an adhesive status, upon activation by inflammation or thrombotic
stimuli. This is due to the rapid conformational change of their integrins, which
acquire an affinity for adhesion substrates. Complex “inside-out” signaling
pathways lead to b
2
integrin activation in leukocytes and a
IIb
b
3
integrin activation
in platelets. Patients with leukocyte adhesion deficiency type III (LAD-III or LAD1-
variant) suffer from recurrent infection and from easy bruising, due to a defective
“inside-out” signaling that prevents integrin activation in both leukocytes and
platelets. This adhesion deficiency underscores common features of “inside-out”
signaling leading to integrins activation in hematopoietic cells. The present review
is focused on neutrophil b
2
integrins and platelet a
IIb
b
3
integrin. It gives the most
recent data on integrins structure and describes the conformational change leading
to the high affinity for ligands. Neutrophil and platelet functions involving integrins
are detailed. It reviews extensively the present knowledge on integrin “inside-out”
signaling pathways triggered by various stimuli in hematopoietic cells.
Key words: neutrophil, platelet, integrin, adhesion, LAD
Correspondance et tirés à part :
L. Halbwachs-Mecarelli
Hématologie 2006 ; 12 (1) : 21-33
Hématologie, vol. 12, n° 1, janvier-février 2006
21
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

La particularité des leucocytes et des plaquettes,
en termes d’adhérence cellulaire, réside dans la
rapidité avec laquelle ces cellules passent de
l’état circulant à l’état de cellules adhérentes.
Entraînées passivement par le flux sanguin, les
plaquettes s’immobilisent instantanément à la surface de
l’endothélium lésé et s’agrègent pour former le thrombus. De
même, les leucocytes ralentissent au contact de l’endothélium
activé par des stimuli inflammatoires et, en quelques minutes,
adhèrent fermement à cet endothélium pour entreprendre une
migration à travers les tissus. Les molécules qui permettent
aux cellules d’effectuer ce changement sont principalement
les intégrines, c’est-à-dire des protéines transmembranaires
exposées sur leur membrane plasmique et capables de lier
des ligands cellulaires ou matriciels. En effet, les intégrines
leucocytaires et plaquettaires (intégrines b
2
et a
IIb
b
3
, comme
nous le verrons en détail, mais aussi intégrines b1) sont
susceptibles de passer très rapidement d’une conformation
inerte à une conformation active ayant une forte affinité pour
les ligands.
L’importance des processus d’adhérence des leucocytes et
des plaquettes a été en grande partie révélée par l’observa-
tion de déficits génétiques touchant les intégrines : chez
l’homme, le déficit génétique en chaîne b2 de l’intégrine est
à l’origine d’un syndrome sévère, le déficit d’adhérence
leucocytaire de type 1 ou leukocyte adhesion deficiency
type 1 (LAD-1), responsable chez l’enfant d’infections bacté-
riennes récurrentes létales. Ce déficit se traduit par une
incapacité des cellules de l’immunité innée (neutrophiles et
macrophages) à adhérer à l’endothélium vasculaire, à trans-
migrer vers les sites inflammatoires et à effectuer d’autres
fonctions dépendantes de l’adhérence et cruciales dans la
réponse immunitaire, comme la phagocytose, l’explosion
respiratoire, la dégranulation. De la même façon, le déficit
génétique en intégrine plaquettaire aIIbb3 (GPIIbIIIa) se tra-
duit par une pathologie, connue sous le nom de thrombasthé-
nie de Glanzman, caractérisée par de graves troubles hémor-
ragiques dus à un défaut d’agrégation des plaquettes.
Plus récemment, un nouveau déficit génétique, touchant la
fonction des intégrines à la fois des leucocytes et des plaquet-
tes, a été décrit sous le nom de LAD-III ou LAD I-like. À ce jour,
quatre patients ont été décrits [1-4] avec un syndrome carac-
térisé par des infections à répétitions dues à un défaut
d’adhérence des cellules de l’immunité, et par des saigne-
ments dus à un défaut d’adhérence des plaquettes. Les
cellules de tous ces patients exprimaient des taux normaux
d’intégrines. Cependant, les leucocytes et les plaquettes de
ces patients présentaient un défaut fonctionnel de leurs inté-
grines, ce qui n’était pas le cas des autres cellules de
l’organisme. Si la nature exacte de ce déficit est encore
inconnue, il touche un élément de signalisation commun aux
cellules du système hématopoïétique et impliqué dans le
passage des intégrines de leur conformation inerte vers leur
conformation active. Cette observation révèle l’existence de
voies communes de transduction, mises en jeu par toute une
variété de stimuli inflammatoires et thrombotiques pour abou-
tir à l’activation des intégrines leucocytaires ou plaquettaires.
Nous nous proposons de passer ici en revue ces voies de
signalisation.
Présentation des intégrines
et de leurs ligands
Les intégrines forment donc une famille de récepteurs trans-
membranaires [5] permettant aux cellules d’adhérer à diffé-
rents substrats et ligands solubles, exposés par la matrice
extracellulaire ou exprimés par les cellules de l’organisme.
Ces récepteurs sont des hétérodimères composés de deux
sous-unités ab liées de façon non covalente. Chez les mammi-
fères, 18 chaînes aet 8 chaînes bont été décrites, mais on ne
compte que 24 combinaisons (ou récepteurs) ab. Les intégri-
nes sont classées selon le type de la chaîne bpartagée par
différentes chaînes a, qui détermine un répertoire spécifique
de ligands. Elles sont synthétisées et glycosylées au niveau du
Golgi, où elles s’associent en dimères. Cette association est
une condition obligatoire à la stabilité et à l’expression du
dimère au niveau de la membrane.
Les intégrines partagent entre elles la même structure, qui
comprend un large domaine extracellulaire et un domaine
cytoplasmique court, séparés par une portion transmembra-
naire (figure 1).
Les segments extracellulaires des intégrines sont asymétri-
ques et forment une « tête » globulaire portée par deux
« pieds » ancrés dans la membrane. Ces derniers possèdent,
au niveau de leur structure, un domaine flexible, ou
« genou », qui permet au récepteur exprimé à la membrane
d’adopter une forme fléchie ou une forme tendue (encart
figure 1).
La partie globulaire de l’hétérodimères ab assure la fonction
d’adhérence du récepteur grâce à la présence d’un ou deux
domaines I : l’inserted domain (I), encore appelé domaine A
en raison de son homologie avec le domaine A du facteur
von Willebrand [6] (FVW), représente le site d’interaction
avec le ligand. Il est présent dans la moitié des sous-unités aet
dans toutes les sous-unités b, avec une structure très similaire
appelée I-like. Le domaine I-like joue un double rôle, selon
que la chaîne aassociée porte ou non un domaine I. Quand
le domaine I de la sous-unité aest absent (par exemple la
chaîne a
IIb
de l’intégrine plaquettaire a
IIb
b
3
), la liaison avec
le ligand est totalement assurée par le domaine I-like de la
chaîne b. Dans le cas des intégrines leucocytaires b
2
,la
chaîne a(a
M
,a
L
,a
X
et a
D
) possède un domaine I qui assure la
liaison avec le ligand. Le domaine I-like de la sous-unité b
devient alors un domaine régulateur de son homologue I
[7, 8].
La spécificité de l’interaction est régie par une séquence
déterminant la spécificité du ligand SDL (specificity-determing
loop), située au niveau des domaines I et I-like.
Hématologie, vol. 12, n° 1, janvier-février 2006
22
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Les études cristallographiques du domaine I de la chaîne a
M
ont mis en évidence deux conformations possibles en relation
directe avec la fonction du récepteur ab :
– La conformation fermée, de bas niveau énergétique et
adoptée par défaut par l’intégrine à la surface de la cellule
circulante, correspond à l’état inactif de faible affinité pour le
ligand ;
– La conformation ouverte, induite, dépendante des cations
(Mg
2+
,Mn
2+
) et à plus haut niveau énergétique, correspond
à l’état actif de forte affinité pour le substrat. C’est le substrat
lui-même qui stabilise l’état actif de l’intégrine en liant le
domaine I/I-like au niveau d’un site de liaison appelé MIDAS
(metal ion-dependant adhesion site).
Ainsi l’intégrine, selon l’état de son domaine I/I-like, peut ou
non lier son ligand. En effet, cette liaison se fait entre le site
MIDAS du domaine I et un motif RGD (arginine-glycine-acide
aspartique), présent sur le substrat : les cations, dont dépend
l’interaction, établissent des liaisons avec les résidus du
domaine I d’une part et avec le résidu glutamine du motif
RGD d’autre part.
Les deux pieds de l’intégrine sont formés de domaines
différemment articulés les uns par rapport aux autres : quatre
domaines de la famille des facteurs de croissance EGF
(epidermal growth factor-like), se caractérisant par leur struc-
ture rigide et deux domaines Calf(mollet)-1 et Calf-2 solide-
ment liés entre eux. Ils forment ainsi une sorte de tige
soutenant la partie de « tête » N-terminale.
Par ailleurs, les liaisons entre les domaines thigh (cuisse) et
Calf-1 de la chaîne a, ou les domaines Hybride et EGF de la
chaîne bsont flexibles à la manière d’un genou permettant à
la partie N-terminale de l’intégrine de s’articuler entre une
position droite et une position fléchie.
Les domaines intracytoplasmiques courts des deux sous-
unités de l’intégrine n’ont aucune fonction enzymatique intrin-
sèque (kinase, phosphatase...) mais ils participent directe-
ment à la régulation de l’activation et de la signalisation des
intégrines. En effet, ils interagissent avec différentes molécu-
les cytoplasmiques [9-11], dont certaines sont critiques pour
l’activation de l’intégrine, comme nous le verrons par la suite.
Domaine
transmembranaire
DOMAINE EXTRACELLULAIRE
Domaine
intracellulaire
Thigh
Hybride
E4
E3
Activation
Inactivation
E2E1
Calf
2 I
I-like
Calf
1
Figure 1. Structure de l’intégrine.
L’intégrine (inactive) sous sa conformation de faible affinité est fléchie, la sous-unité arecouvrant la sous-unité b. Le domaine
extracellulaire est composé de :
- la chaine a, formée par les domaines : Calf-2,Calf-1,Thigh et b-propeller, porteur d’un domaine I (a
M,L,X,D
...) ou non (a
IIb
);
- la chaine b, formée par les domaines : b-TD, E4, E3, E2, E1 ainsi que le domaine Hybride porteur d’un domaine I-like.
Les jonctions Calf-1/Thigh ainsi que E2-E1/Hybride sont flexibles. Ceci permet à l’intégrine de se redresser lors de son activation
(encadré). Le domaine intracellulaire est court et porteur de plusieurs sites d’interaction avec des composants cytoplasmiques.
Hématologie, vol. 12, n° 1, janvier-février 2006
23
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Ligands des intégrines
La séquence RGD (arginine-glycine-acide aspartique) est
présente dans de nombreuses protéines ligands des intégri-
nes [12], qu’il s’agisse de protéines matricielles, de protéines
glycosylées de surface des cellules ou de protéines solubles.
Ce motif est universellement reconnu par plusieurs intégrines.
D’autres peptides, comme GFOGER [13], reconnu sur le
collagène par l’intégrine a
2
b
1
, ou KQAGDV [14], reconnu
sur le fibrinogène par l’intégrine a
IIb
b
3,
participent notam-
ment au recrutement des plaquettes.
Intégrines leucocytaires ayant en commun
la chaîne b2 (CD18)
Cette sous-famille d’intégrine est spécifique aux leucocytes.
Elle comprend quatre intégrines : aLb2 (LFA-1,
CD11a/CD18), aMb2 (Mac-1, CD11b/CD18), aXb2
(CD11c/CD18) et aDb2, présentant des panels d’expression
différents. L’intégrine aLb2 est la plus exprimée sur les lym-
phocytes, alors que aMb2 est la principale intégrine des
polynucléaires neutrophiles et des monocytes. L’isoforme
aXb2 s’exprime aussi sur les lymphocytes, les macrophages
et les cellules NK (natural killer). L’isoforme aDb2 n’est
présent que sur les macrophages.
Dans les polynucléaires circulants, les réserves d’intégrines
b2 sont majoritairement stockées dans les granules spécifi-
ques et les vésicules de sécrétion et sont rapidement mobilisa-
bles sous l’effet de faibles concentrations d’agonistes.
Les intégrines b2 sont des récepteurs d’adhérence pouvant
lier différents substrats tels que : ICAM-1, ICAM-2, le fibrino-
gène, le facteur X, iC3b, le plasminogène... Les intégrines
aMb2 (aussi appelée CR3, complement receptor 3)etaXb2
(CR4) sont des récepteurs pour le facteur du complément
iC3b. Elles participent à ce titre à la réponse immune en
interagissant avec les pathogènes opsonisées par le complé-
ment et coopèrent avec d’autres récepteurs comme le CR1 et
les récepteurs FccR au cours du processus de la phagocytose.
Intégrines plaquettaires
Intégrine a
IIb
b
3
(GPIIb,IIIa)
a
IIb
b
3
est l’intégrine plaquettaire type, exprimée exclusive-
ment dans les cellules du lignage mégacaryocytaire. L’hétéro-
dimère a
IIb
b
3
est fortement exprimé dans les plaquettes
matures (environ 100 000 copies par plaquette), au niveau
de la membrane plasmique et des granules cytoplasmiques,
où il représente une réserve mobilisable après activation de
la plaquette.
L’intégrine a
IIb
b
3
joue un rôle physiologique primordial dans
l’homéostasie et l’agrégation plaquettaire. a
IIb
b
3
est une
molécule d’adhérence pouvant lier plusieurs types de subs-
trats solubles ou immobilisés sur une surface : le facteur von
Willebrand (FVW), le fibrinogène, la fibronectine, la vitro-
nectine, la thrombospondine...
Intégrine a
2
b
1
L’intégrine a
2
b
1
a été le premier récepteur aux collagènes
(type I, II et IV) identifié sur la plaquette. Dans la plaquette au
repos, l’intégrine a
2
b
1
se lie très faiblement au collagène
soluble. En revanche l’activation de la plaquette potentialise
la liaison de a
2
b
1
au collagène et cette intégrine joue alors un
rôle majeur dans l’adhérence des plaquettes à la matrice
sous-endothéliale lors de la thrombogenèse.
Enfin, aussi bien les plaquettes que les neutrophiles expriment
d’autres intégrines qui participent à leurs fonctions, comme
a
V
b
3
,a
4
b
1
,a
5
b
1
,a
6
b
1
et a
9
b
1
.
Rôle des intégrines
dans les fonctions des neutrophiles
Les données exposées ici sur la structure, l’activation des
intégrines de la sous-famille b2 et sur leur rôle dans la
migration concernent tous les leucocytes, lymphocytes et
monocytes aussi bien que polynucléaires. La taille de cette
revue ne nous permet pas de développer toutes les fonctions
des leucocytes impliquant les intégrines. Nous nous concen-
trerons donc sur celles des polynucléaires neutrophiles
(figure 2). Le polynucléaire neutrophile est un acteur majeur
de l’inflammation [15]. Il est rapidement recruté sur les sites
inflammatoires et est un élément essentiel de la réponse
immune innée aux microbes, grâce au contenu toxique de ses
granules et à sa capacité à phagocyter et à tuer les particules
pathogènes, notamment par la production de dérivés toxi-
ques de l’oxygène (reactive oxygen species, ROS). Il parti-
cipe aussi au recrutement ultérieur des autres cellules immuni-
taires comme les monocytes/macrophages.
Adhérence ferme à l’endothélium
Ces particularités du neutrophile découlent de son aptitude à
passer d’un état circulant à un état adhérant, sous l’effet des
stimuli inflammatoires et ceci grâce aux propriétés dynami-
ques de ses intégrines. Il s’agit de la première étape du
recrutement du neutrophile au cours du processus inflamma-
toire. Elle met en jeu une étroite collaboration entre le
neutrophile et les cellules endothéliales qui tapissent la
lumière des capillaires pulmonaires et des veinules post-
capillaires. À proximité immédiate d’un foyer infectieux
et/ou inflammatoire, les cellules endothéliales présentent à
leur surface des stimuli inflammatoires ainsi que des molécu-
les d’adhérence particulières, les sélectines [16]. Les interac-
tions réversibles des sélectines avec leurs ligands de la famille
des mucines amorcent :
– la décélération du neutrophile pris dans le flux sanguin
(rolling),
– l’activation des récepteurs du chimiotactisme du neutro-
phile au contact des stimuli exposés par l’endothélium (IL-8,
notamment).
Ainsi, naissent dans le neutrophile des signaux de pré-
activation (priming) qui déclenchent l’activation des intégri-
nes leucocytaires b2. Le ralentissement du neutrophile permet
à ses intégrines de lier fermement leurs ligands endothéliaux,
de la famille des molécules d’adhérence intercellulaire (ICAM),
et d’immobiliser le neutrophile à la surface endothéliale.
Hématologie, vol. 12, n° 1, janvier-février 2006
24
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Locomotion et transmigration
L’engagement des intégrines avec leur ligand déclenche un
réarrangement du cytosquelette cellulaire autour de leur
partie intracytoplasmique, ce qui renforce leur ancrage dans
la cellule et permet l’adhérence ferme du neutrophile. Par
cette même réorganisation du cytosquelette, le neutrophile
adopte une forme polarisée [17] avec :
– La mise en place, vers l’avant de la cellule, d’un large front
de migration, site d’intense activité de polymérisation de
l’actine avec émission de filopodes et de lamellipodes.
Ces projections membranaires portent des intégrines qui les
stabilisent en adhérant et permettent ainsi l’avancement de la
cellule. Au niveau du front de migration du neutrophile, se
concentrent aussi les récepteurs aux chimioattractants qui, à
l’image d’un organe olfactif, lui permettent de s’orienter et
d’avancer dans le sens du gradient des stimuli chimioattrac-
tants ;
– La formation de l’uropode à l’arrière du corps cellulaire, où
le cytosquelette se contracte fortement et qui est le site de
décollement de la cellule. Ainsi, l’étalement vers l’avant de la
PSGL-1
Intégrine β2
Inactive Intégrine β2
active
Sélectine ICAM-1
Endothélium
PECAM-1/
CD99
Ligands matriciels
Bactéries opsonisées
JAM
Neutrophile circulant Rolling Polarisation - adhérence ferme Transmigration de l’endothélium
MigrationÉlimination du pathogène
Front de
migration
Uropode
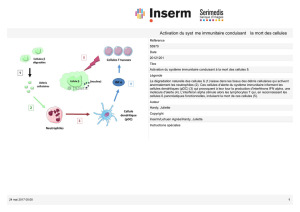
Figure 2. Les différentes étapes du recrutement des neutrophiles sur les sites inflammatoires.
À l’approche du site inflammatoire, le neutrophile entre en contact avec l’endothélium activé par les stimuli inflammatoires. Les interactions
réversibles entre les sélectines et leurs ligands ralentissent la course du neutrophile et le mettent en contact avec les stimuli inflammatoires
exposés par l’endothélium. Ceci préactive le neutrophile et déclenche la signalisation inside-out activatrice des intégrines b2.
La liaison des intégrines b2 à leurs ligands ICAM-1 est à l’origine de la polarisation et de l’adhérence ferme du leucocyte.
Le neutrophile se meut sur la surface de l’endothélium par des réactions d’adhérence des intégrines au niveau du front de migration,
stabilisant les projections membranaires et une désadhérence au niveau de l’uropode, permettant sa rétraction et le recyclage des
intégrines vers l’avant.
Au niveau de la jonction endothéliale et en collaboration avec le neutrophile, les cellules endothéliales desserrent leur jonction et offrent au
leucocyte des ligands (JAM) de substitution pour ses intégrines b2, en plus des interactions homophiles des molécules PECAM-1 et CD99
lui permettant de progresser à travers l’endothélium vers la matrice.
La migration dans la matrice met en jeu, en plus des intégrines b2, d’autres types d’intégrines (b1, b3...) qui se lient à des ligands matriciels
divers.
Sur le site inflammatoire, les intégrines b2 participent au processus de phagocytose en liant spécifiquement le facteur C3 du complément
opsonisant des bactéries.
Hématologie, vol. 12, n° 1, janvier-février 2006
25
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%