Infection à virus West Nile : le point sur une maladie virale émergente

18
La Lettre de l’Infectiologue - Tome XVIII - n° 1 - janvier-février 2003
MISE AU POINT
e virus West Nile (WN) a récemment émergé en tant
que problème de santé publique majeur avec la surve-
nue d’épidémies à New York, en Roumanie, en Israël
et en Russie depuis 1996. Ces épidémies ont été caractérisées
par un nombre anormalement élevé de formes sévères et/ou
létales par comparaison avec les épidémies précédentes.
LE VIRUS
Le virus WN a été isolé en 1937 à partir du sang d’une femme
adulte en Ouganda (1). Depuis, des centaines de souches ont été
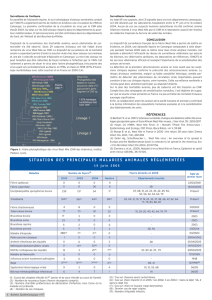
isolées à partir d’humains, d’oiseaux, de moustiques en Afrique,
Moyen-Orient, Europe et Asie (figure 1). En 1942, il a été éta-
bli que le virus WN présentait une parenté antigénique avec
d’autres arbovirus pouvant causer des encéphalites (virus de
l’encéphalite de Saint-Louis, virus de l’encéphalite japonaise)
(2, 3). Le virus WN appartient au genre Flavivirus au sein de la
famille Flaviviridae. Le dernier rapport du Comité internatio-
nal de taxonomie virale a estimé que, après avoir été consi-
dérés comme deux virus différents, les virus Kunjin et WN
étaient deux sous-types d’une même espèce virale (4). Le genre
Flavivirusinclut plus de 70 virus, parmi lesquels plus de la moi-
tié peuvent infecter l’homme. Le virus WN est antigéniquement
et génétiquement proche des virus de l’encéphalite de Saint-
Louis, de l’encéphalite japonaise, de l’encéphalite de Murray
Valley, Usutu, Kokobera, Koutango, Statford et Alfuy (5).
Il existe des variations antigéniques parmi les différents isolats
de virus WN. Les tests croisés d’inhibition de l’hémagglutina-
tion ont permis de les séparer en deux groupes majeurs (6).Plu-
sieurs études ont permis de déterminer des différences dans la
virulence des diverses souches, mais l’interprétation de ces
résultats est compliquée par le fait que les isolats étudiés pré-
sentaient des histoires différentes (nombre de passages sur cul-
ture cellulaire, d’inoculation à l’animal…). L’existence de ces
deux groupes (ou lignages) a été confirmée par des études géné-
tiques récentes réalisées à partir d’une vingtaine de souches iso-
lées entre 1950 et 1990 (7). Des souches des deux lignages cir-
culent en Afrique et ont des distributions sympatriques dans
certaines régions. Les souches de virus Kunjin et WN isolées
lors des récentes épidémies de Roumanie, des États-Unis,
Infection à virus West Nile : le point sur une maladie
virale émergente
West Nile virus infection : an emerging viral disease
!
R.N. Charrel*, X. de Lamballerie*
* Unité des virus émergents (EA 3292, IFR 48, IRD UR 0,34), faculté de médecine,
13005 Marseille.
RÉSUMÉ.
Le virus West Nile (famille Flaviviridae, genre Flavivirus), isolé pour la première fois en Afrique en 1937, est un arbovirus transmis
par la piqûre d'un moustique du genre Culex. Le virus West Nile a récemment attiré l'attention par plusieurs épidémies et épizooties en France,
en Russie, en Roumanie, en Israël et surtout aux États-Unis, territoire qui en était exempt jusque-là ; il y a été introduit en 1999 et s'est ensuite
établi de façon durable, avec une dissémination à 27 États de l'Est des États-Unis en 2001 et une dissémination massive de la côte Est à la côte
Ouest en 2002 (44 États dont 40 dans lesquels des cas humains ont été recensés, plus de 2 000 cas humains avec un taux de mortalité de 5 %).
L' homme est une impasse épidémiologique dans le cycle naturel du virus. Parmi les patients infectés par le virus, une minorité développera une
forme symptomatique, et seule une faible partie de ces derniers présentera une forme neurologique. Nous présentons ici une revue de la litté-
rature concernant l'épidémiologie et la maladie, ainsi que les connaissances acquises sur le virus, ses vecteurs et ses hôtes. Nous décrivons la
situation en France à la suite de l'épizootie équine survenue en 2000 et les modalités de la surveillance mise en place à cette occasion.
Mots-clés :
Virus West Nile - Virus Kunjin - Arbovirus - France.
Keywords :
West Nile virus - Kunjin virus - Arbovirus - France.
L
Figure 1. Distribution géographique des souches de virus West Nile
identifiées par isolement viral.

La Lettre de l’Infectiologue - Tome XVIII - n° 1 - janvier-février 2003
19
MISE AU POINT
d’Israël et de Russie appartiennent toutes au lignage I (8-10).
Les isolats roumains étaient très proches de souches d’Afrique
subsaharienne, suggérant leur introduction en Roumanie à par-
tir d’oiseaux migrateurs (10). Les souches isolées à New York
étaient toutes génétiquement très proches entre elles (identité
>99,8 %) et présentaient le même degré d’homologie avec une
souche aviaire isolée en Israël en 1998, suggérant que les
souches américaines avaient été introduites à partir de la région
méditerranéenne (8). Bien que la comparaison ait été effectuée
sur une région très courte du génome (165 nucléotides), les
souches de l’épidémie de Volgograd (Russie) semblaient géné-
tiquement identiques à celles de Roumanie (1996), et très
proches de celles de New York (1999) (9). À ce jour, les infec-
tions humaines ont été causées uniquement par des isolats
appartenant au lignage évolutif I (figure 2).
LE VECTEUR
Le virus WN est un arbovirus [arthropod-borne virus, virus
transmis par un/plusieurs vecteur(s) arthropode(s)]. De nom-
breuses études ont démontré que plusieurs espèces de mous-
tiques étaient capables, en conditions expérimentales, d’être
infectées par le virus WN et de le transmettre. Les premières
études de terrain furent menées en Égypte au début des années
1950 ; elles ont montré que bien que plusieurs espèces de mous-
tiques du genre Culex (Culex antennatus, Culex univittatus,
Culex pipiens) soient impliquées dans la circulation du virus
(11), C. univittatus était le vecteur principal (12). Culex modes-
tus a été identifié comme le vecteur principal en France dans la
région de Camargue au cours de l’épidémie de 1962. Culex vish-
nui est le vecteur reconnu en Inde et au Pakistan (13, 14). Le
virus WN a été isolé de moustiques différents de ceux du genre
Culexet d’autres arthropodes (tiques), mais leur rôle en tant que
vecteur semble peu important en zone d’épizootie établie.
Dans les épidémies décrites depuis 1996, C. pipiens est le vec-
teur ayant joué le rôle principal. Il a été établi que C. pipiens
avait toutes les caractéristiques nécessaires à sa compétence
dans le cycle du virus WN (15). Ces données de terrain corro-
borent des résultats établis antérieurement qui démontraient
que C. pipiens pouvait être infecté à la suite d’un repas sanguin
et, par la suite, transmettre le virus WN par piqûre (16). Deux
points très importants ont été notés à l’occasion de l’épidémie
de New York en 1999 : 12 espèces différentes de moustiques
ont été testées positives pour le virus WN (17) ; le virus WN a
été isolé de C. pipiens femelles pendant la période hivernale
(18) ; ces moustiques avaient donc la capacité d’initier un nou-
veau cycle dès le retour de la saison chaude. Cette information
pourrait permettre d’expliquer l’installation du virus WN sur
le continent américain.
L’HÔTE
Les humains ont été les premiers hôtes vertébrés identifiés par
isolement du virus et par mise en évidence d’anticorps neutra-
lisants (1-3). Il a été rapidement démontré que les humains
infectés par le virus WN ne présentaient pas de virémie suffi-
samment élevée pour qu’ils puissent infecter à leur tour des
moustiques (19) ; ce résultat permettait d’exclure l’homme
comme le réservoir naturel du virus WN, et de le considérer
plus certainement comme une impasse épidémiologique. Des
infections expérimentales par le virus WN conduites sur des
patients atteints de cancer à un stade avancé ont démontré que
la sévérité des manifestations cliniques était corrélée à la durée
de la virémie (20). Les études de terrain menées en Égypte dans
les années 50 ont déterminé que les oiseaux sauvages étaient
des hôtes importants dans le cycle naturel du virus (21) ; dans
cette région endémique, des anticorps neutralisants ont été
retrouvés chez 48-100 % des individus de certaines espèces
aviaires. Ces études ont établi que ces oiseaux développaient
des virémies suffisamment élevées pour leur permettre d’in-
fecter des moustiques naïfs. Par la suite, ces résultats ont été
confirmés par d’autres études réalisées en Afrique du Sud, en
Israël et en Inde (22-24). Des études sérologiques ont démon-
tré que de nombreuses espèces de mammifères sauvages et
domestiques pouvaient être infectées par le virus WN, mais le
faible nombre de souches virales obtenues à partir de celles-ci
suggère que les titres virémiques sont faibles et qu’ils partici-
pent donc vraisemblablement peu à la survivance à long terme
du virus (25). Une épizootie massive a touché les corbeaux en
1999 aux États-Unis, tuant des milliers d’individus. Il est à noter
que c’est cette soudaine mortalité inexpliquée chez les corbeaux
de Central Park qui a donné l’alerte. Si les corbeaux ont été les
plus touchés, des dizaines d’autres espèces aviaires ont été
infectées. La découverte de virus WN dans le cerveau d’un fau-
con au milieu de l’hiver suggère soit l’existence d’une virémie
République centrafricaine
République centrafricaine
République centrafricaine
République centrafricaine
République centrafricaine
République centrafricaine
Figure 2. Relations phylogénétiques entre différentes souches de
virus West Nile par analyse d’une région du gène de l’enveloppe
(227 nucléotides) par technique de neighbor-joining. Les séquences
sont identifiées par leur numéro d’accession dans la banque de don-
nées GenBank suivi du pays d’origine de la souche. Les valeurs de
bootstrap supérieures à 70 % sont indiquées.

prolongée, soit un second mode de transmission indépendant
des moustiques (26). Les oiseaux ont joué un rôle clé dans la
dissémination du virus au cours de l’épidémie/épizootie
américaine : 5 États touchés en 1999, 12 en 2000, 27 en 2001,
44 en 2002 (figure 3, tableau I).
Il semble épidémiologiquement probable que les oiseaux migra-
teurs sont impliqués dans la dissémination des souches du virus
WN, mais aucune preuve directe n’a été apportée à ce jour.
LA MALADIE CHEZ L’HOMME
Les premiers isolements du virus WN ont été réalisés chez des
patients asymptomatiques ou présentant des syndromes
fébriles isolés. Lorsque les infections touchaient des enfants,
ceux-ci présentaient des épisodes fébriles aigus sans atteinte
neurologique associée (11). Il fut rapidement établi que la plu-
part des infections par le virus WN étaient asymptomatiques
ou trop peu symptomatiques pour motiver une consultation
médicale. La première épidémie virologiquement prouvée eut
lieu en Israël dans une communauté agricole en 1951 (27) :
123 (41 %) des 303 habitants de la communauté manifestèrent
des signes cliniques. Adultes et enfants présentèrent un syn-
drome fébrile avec une résolution spontanée plus rapide chez
les enfants ; aucune méningite ou encéphalite ne fut rappor-
tée, bien que dix des enfants aient présenté un signe de Brud-
zinski. Sur 50 cas rapportés l’année suivante chez de jeunes
soldats en Israël, un seul cas de méningite aseptique fut noté.
En 1957, toujours en Israël, une épidémie importante permit
d’évaluer les manifestations cliniques dans trois groupes : sol-
dats, enfants et adultes, personnes âgées. Dans les deux pre-
miers groupes, trois cas de méningo-encéphalites furent rap-
portés. Sur les 45 personnes âgées, 12 présentèrent une
méningo-encéphalite sans mortalité associée (28), alors que
les 33 autres présentèrent un syndrome fébrile. Quatre formes
encéphalitiques diffuses mortelles furent notées, mais l’ab-
sence de confirmation sérologique empêche de les attribuer
définitivement au virus WN. Cette épidémie a prouvé que les
formes étaient d’autant plus sévères qu’elles survenaient chez
des patients âgés.
Cette épidémie de 1957 en Israël fut la seule pour laquelle un
nombre important de formes neurologiques fut noté avant l’épi-
démie de 1996 en Roumanie. Cependant, de nombreux cas spo-
radiques furent associés à des manifestations sévères incluant
des cas mortels d’encéphalite chez des enfants en Inde (29) et
d’hépatites en République centrafricaine (30).
Les données des épidémies de Roumanie (1996) et New York
(1999) ont permis de confirmer que moins de 1 % des patients
infectés présentaient une forme neurologique (31, 32). Les
formes les plus sévères et les infections mortelles surviennent
habituellement chez des sujets âgés, comme cela avait été décrit
en 1957. La mortalité des cas médicalisés était de 4,3 % en
Roumanie (1996) et de 11 % lors de l’épidémie de New York
(1999). À cette occasion, plusieurs cas furent associés à des
syndromes de Guillain-Barré (33).
Il est important de souligner que parmi les patients infectés par
le virus, une minorité développera une forme symptomatique,
et seule une faible partie présentera une forme neurologique.
L’étude réalisée pendant l’épidémie de New York (1999) a per-
mis de déterminer que 20 % seulement des infections étaient
symptomatiques, et que 0,7 % des patients avaient présenté une
forme sévère de type méningo-encéphalite (32). Si cette pro-
portion est extrapolable aux 66 formes neurologiques recen-
sées aux États-Unis en 2001, alors la partie immergée de l’ice-
berg peut être estimée à 10 000 cas d’infection par le virus WN
aux États-Unis en 2001. Il est important de souligner que ces
données ne peuvent pas être extrapolées à toutes les épidémies
de virus WN. Toutefois, elles confirment qu’une majorité de
cas sont asymptomatiques et que la plupart des formes symp-
tomatiques ne sont pas sévères.
Plus généralement, l’infection par le virus WN se caractérise
par une période d’incubation de 2 à 6 jours. Les formes typiques
sont généralement peu sévères avec fièvre, céphalées, myalgies
et anorexie. L’évolution de la fièvre peut être biphasique. Un
exanthème est observé dans la moitié des cas. Une lymphadé-
nopathie généralisée est fréquente. Des manifestations gastro-
intestinales (nausées, vomissements, diarrhée, douleurs abdo-
minales) et à type de pharyngite sont décrites. L’évolution se
fait sur 3-6 jours avec résolution spontanée sans séquelle. Les
formes neurologiques (méningite aseptique, méningo-encé-
phalites) sont principalement décrites chez des sujets âgés. Cer-
20
La Lettre de l’Infectiologue - Tome XVIII - n° 1 - janvier-février 2003
MISE AU POINT
Tableau I. Évolution de la situation épidémique du virus West Nile
aux États-Unis (au 11 décembre 2002).
"1999 : 5 États touchés, 59 cas humains dont 7 décès
"2000 : 12 États touchés, 21 cas humains dont 2 décès
"2001 : 27 États touchés, 66 cas humains couvrant 10 États, pas de décès
"au 11 décembre 2002: 44 États touchés, 40 États ayant rapporté des cas
humains, 3 873 cas humains dont 246 décès ; le virus West Nile a atteint la
côte Ouest (Californie : 1er cas humain décrit en septembre 2002)
Une information exhaustive avec mise à jour quotidienne sur la situation
aux États-Unis est disponible gratuitement sur le site ProMed
mail : http://www.promedmail.org
Figure 3. Dissémination du virus West Nile aux États-Unis de 1999 à 2002.
Source
http://www.cdc.gov/ncidod/dvbid/westnile/surv&control.htm

taines complications à type de myélite antérieure, de myocar-
dite ou de pancréatite ont été rapportées. La principale mani-
festation biologique est une leucopénie.
Aucun traitement antiviral n’est disponible actuellement.
Cependant, quelques études ont montré que :
#La ribavirine à dose élevée (200 µM) inhibait la réplication
et la cytopathogénicité du virus sur les cellules nerveuses
humaines (34) ; il semble que la ribavirine puisse prévenir
l’infection virale, mais que son effet sur des cellules infectées
soit beaucoup plus faible (35).
#L’interféron alpha pourrait avoir un effet prophylactique et
thérapeutique sur un modèle sur cellules Vero (35) ; ces résul-
tats restent à confirmer sur modèle expérimental animal, comme
celui décrit par l’équipe du Dr Tesh à l’université du Texas à
Galveston (36, 37).
#Les concentrés d’immunoglobulines polyvalentes d’Israël
(pays où la circulation du virus WN est endémique) contien-
nent des titres d’anticorps spécifiques à des titres de l’ordre de
1/1 600 ; l’utilisation de ces immunoglobulines n’a pour l’ins-
tant été rapportée que pour un patient, et il est nécessaire d’éva-
luer plus largement cette approche thérapeutique (38). Les
concentrés collectés aux États-Unis ne contiennent pas d’anti-
corps spécifiques du virus WN.
#La protection conférée par la souche vaccinale (SA 14-2-8)
du virus de l’encéphalite japonaise protège le hamster contre
l’infection par le virus WN (37) ; ces résultats sont à confir-
mer avec le vaccin JE-VAX. Ils ouvrent des perspectives inté-
ressantes pour la protection des sujets à risque (sujets âgés,
personnel de laboratoire, vétérinaires…), mais également pour
tenter d’enrayer et/ou de faire diminuer la circulation du virus
WN aux États-Unis par vaccination massive des hôtes ampli-
ficateurs.
LA MALADIE CHEZ LES ANIMAUX
La caractéristique la plus surprenante de l’épidémie de New
York (1999) fut la mortalité très élevée chez les oiseaux infec-
tés. Le corbeau (Corvus brachyrhynchos) a été l’espèce la plus
touchée, mais des infections ont été décrites chez environ
75 autres espèces aviaires. Les raisons expliquant cette morta-
lité très élevée ne sont pas élucidées. Parallèlement à l’épidé-
mie de New York (1999-2000), une épizootie équine a été iden-
tifiée, avec plus de 80 cas confirmés. Il semble que tous les
chevaux ayant présenté des manifestations neurologiques aient
été adultes, avec un âge moyen largement plus élevé que les
chevaux infectés n’ayant présenté que des formes non neuro-
logiques. Pendant la même période, des cas isolés d’infections
fatales ont été rapportés chez un chat, un putois, un écureuil,
un lapin, ainsi que des cas chez des chauves-souris et un ours
brun. Avant 1999, les seuls animaux chez lesquels une patho-
logie associée au virus WN avait été démontrée sont les che-
vaux (Égypte, 1959 ; France, 1965). De nombreuses espèces
de mammifères et d’oiseaux ont été infectées expérimentale-
ment, mais ces données doivent être interprétées avec prudence
en raison des modalités d’administration du virus ne pouvant
être assimilées à une exposition naturelle.
FACTEURS DE RISQUE
L’étude des épidémies de 1952-1954 en Égypte a retrouvé une
transmission du virus WN plus intense pendant les mois d’été
de juin à septembre. La moitié des enfants de 4 ans et plus de
90 % des sujets de moins de 20 ans avaient des cicatrices séro-
logiques. Parmi les facteurs favorisant la circulation du virus,
ont été identifiées une forte densité de population, une irriga-
tion et une densité importantes de vecteur. Les épidémies d’Is-
raël sont survenues en été, dans une région anciennement recou-
verte de marécages et avec une irrigation importante. Les
caractéristiques associées aux épidémies de Roumanie et
d’Afrique du Sud étaient des précipitations anormalement
importantes, une forte densité en vecteur, des températures très
élevées.
Les épidémies décrites depuis 1996 ont comme caractéristiques
communes : des zones urbaines à haute densité de population ;
la proximité de larges rivières créant un habitat humide favo-
rable à une densité aviaire importante ; la présence du vecteur
C. pipiens ; un nombre anormalement élevé de formes neuro-
logiques sévères.
Parmi les facteurs de risque, on note la présence de moustiques
dans et/ou autour de l’habitation, un environnement humide,
un grand nombre de piqûres de moustique chaque jour et des
activités extérieures.
LA SITUATION EN FRANCE
Tous les cas décrits étaient localisés dans la région de la
Camargue. Il existe des données concernant des épizooties
équines en 1942, 1962, 1964-65 et 2000. La description
clinique des cas humains établie depuis 1935 rapporte des
“syndromes grippaux estivaux d’évolution courte et bénigne”
avec asthénie profonde durable (44), ainsi que des épisodes
épidémiques caractérisés par une fièvre d’apparition brutale de
3-4 jours avec céphalées, courbatures, injection conjonctivale
et syndrome méningé modéré. Les études des années 60 ont
identifié C. modestus comme le principal vecteur du virus WN
en Camargue. Treize cas humains ont été rapportés entre 1962
et 1964 (40).
Au cours de l’été 2000, une épidémie d’encéphalite équine à
virus WN a été identifiée. La mise en place immédiate d’une
surveillance des cas équins et humains a permis d’identifier un
total de 76 chevaux présentant des manifestations cliniques et
une séroprévalence de 8,3 % sur un total de 5 133 chevaux tes-
tés ; dans la même période, aucun cas humain n’a été recensé
(41). Une étude réalisée sur des patients hospitalisés à Mar-
seille pour méningo-encéphalite ou encéphalite entre 1997 et
2000 n’a pas permis d’incriminer le virus WN comme agent
étiologique (42). Néanmoins, une étude sérologique réalisée
entre septembre et novembre 2000 dans deux groupes de don-
neurs de sang [un groupe de sujets vivant en Camargue
(n=1104) et un groupe de sujets vivant à l’est de Marseille
(n = 1 053)] a démontré que les sujets de Camargue étaient plus
fréquemment (0,7 % versus 0 % ; p < 0,005) porteurs d’anti-
La Lettre de l’Infectiologue - Tome XVIII - n° 1 - janvier-février 2003
21
MISE AU POINT

corps neutralisant le virus WN. L’analyse de l’âge des sujets
positifs permet d’affirmer que le virus WN circule en Camargue
(43).
En 2001, un dispositif de surveillance multidisciplinaire com-
prenant quatre volets a été mis en place afin d’évaluer la cir-
culation du virus et d’éventuels cas équins et humains sous
l’égide du ministère chargé de la Santé (Direction générale de
la santé [DGS]) et du ministère de l’Agriculture (Direction
générale de l’alimentation [DGAL]) (41). Le volet humain
(établissements de soins publics et privés, DDASS, CIRE, Ins-
titut de médecine tropicale du service de santé des armées
[IMTSSA], InVS, Centre national de référence [CNR]) avait
pour objectif d’identifier les cas sévères chez toute personne
ayant séjourné entre le 1er mai et le 31 octobre 2001 dans les
Bouches-du-Rhône, le Gard ou l’Hérault : 33 cas suspects ont
été identifiés, aucun n’a été classé comme confirmé ou pro-
bable. Le volet équin (Direction départementale des services
vétérinaires [DDSV], AFSSA, CNR) avait pour but d’estimer
l’incidence : 31 cas suspects ont été répertoriés ; tous se sont
révélés négatifs. Le volet avifaune (ONCFS, CNR, Cirad-
EMVT, DDSV, Station biologique de la Tour du Valat) avait
pour objectif de surveiller la mortalité, d’effectuer une sur-
veillance sérologique d’oiseaux sauvages et sentinelles : sur un
total de 1 152 analyses réalisées, une séroconversion chez un
canard sentinelle a été identifiée en octobre. Le volet vecteur
a été réalisé par l’Entente interdépartementale de démoustica-
tion du littoral [EID] et l’Unité des virus émergents [UVE] :
14 355 moustiques ont été capturés et répartis en 997 pools qui
ont été testés par RT-PCR : aucun pool n’a été testé positif.
Directions futures
Parmi les points actuellement inconnus ou mal connus qui méri-
tent d’être élucidés dans les années à venir, on citera :
$Le rôle respectif des différentes espèces de moustiques dans
la transmission du virus WN aux oiseaux, aux humains, aux
chevaux et aux autres mammifères.
$La contribution des humains et des chevaux à l’infection des
moustiques par le virus WN.
$L’importance de la transmission non vectorisée (entre
oiseaux, prédateur-proie).
$Le rôle respectif des lignages I et II et l’importance des sous-
lignages dans chaque groupe en termes de niveau d’expression
de la virulence et d’écologie de ces virus.
$Le rôle des moustiques et des oiseaux dans les processus
d’hivernage viral en régions tempérées.
$L’importance des oiseaux migrateurs dans l’introduction ou
la réintroduction du virus WN dans certaines régions d’Europe.
$L’influence des environnements naturels ou modifiés par
l’homme dans l’intensité de la circulation virale.
CONCLUSIONS
Les informations actuellement disponibles sont convergentes
pour affirmer qu’ en France :
$Le virus WN a circulé en Camargue durant les dernières
années (41).
$Il n’est pas établi si le virus est maintenu de façon stable en
Camargue, ou s’il est périodiquement introduit par les oiseaux
migrateurs, ou si les deux phénomènes coexistent.
$La plupart des cas humains sont, comme décrit dans la lit-
térature, asymptomatiques ou pauci-symptomatiques.
$La surveillance de la circulation du virus WN requiert une
stratégie (figure 4) impliquant plusieurs écosystèmes (avifaune
sauvage et oiseaux sentinelles, populations de moustiques,
population équine et populations humaines) au moins pendant
la période d’activité virale correspondant à la période d’acti-
vité des arthropodes (avril à novembre). Parmi les populations
humaines, il est important de mettre en place une sur-
veillance/déclaration des tableaux cliniques compatibles
(fièvres estivales, méningites, méningo-encéphalites, syndrome
de Guillain-Barré) en s’appuyant sur le système sanitaire privé
et public. L’apport des études séro-épidémiologiques dans des
populations de donneurs de sang a montré sa capacité à éva-
luer la circulation du virus dans une région donnée (41).
$Il est indispensable de poursuivre une surveillance de la cir-
culation du virus WN en France pour une meilleure connais-
sance de son éco-épidémiologie dans les départements des
Bouches-du-Rhône, du Gard et de l’Hérault, afin de permettre
une réponse rapide et adaptée pour les années à circulation
virale élevée. La région de Camargue, de par sa taille relative-
ment limitée, son statut de parc régional et la présence de nom-
breuses institutions, est un modèle particulièrement propice à
l’étude éco-épidémiologique du virus WN. "
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Smithburn KC, Hughes TP, Burke AW, Paul JH. A neurotropic virus isolated
from the blood of a native of Uganda. Am J Trop Med Hyg 1940 ; 20 : 471-92.
2. Smithburn KC, Jacobs HR. Neutralization-tests against neurotropic viruses
with sera collected in central Africa. J Immunol 1942 ; 44 : 9-23.
3. Smithburn KC. Differentiation of the West Nile virus from the viruses of Saint-
Louis and Japanese B encephalitis. J Immunol 1942 ; 44 : 25-31.
4. Heinz FX, Collet MS, Purcell RH et al. Family Flaviviridae. In : van
Regenmortel MHV, Fauquet CM, Bishop DHL et al. (eds). Virus taxonomy : clas-
sification and nomenclature of viruses. 7th Report of the International Committee
for the taxonomy of Viruses. San Diego : Academic Press 2000 ; 859-78.
22
La Lettre de l’Infectiologue - Tome XVIII - n° 1 - janvier-février 2003
MISE AU POINT
Méthode de surveillance
Cas humains
Cas vétérinaires
Moustiques
Animaux sentinelles
Oiseaux morts
Temps
Circulation
virale
Figure 4. Estimation de la sensibilité des méthodes de surveillance
du virus West Nile. (D’après J.T. Roehrig, www.cdc.gov).
 6
6
1
/
6
100%