Le muscle, d`où vient-il - iPubli

SYNTHÈSE
Marie-Odile Ott
Benoît Robert
Margaret Buckingham
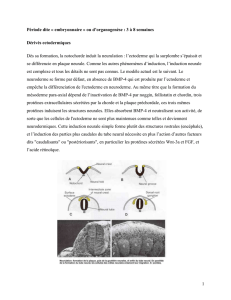
Le muscle, d'où vient-il ?
in situ
N
1

1

90
1

1

A
B
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%