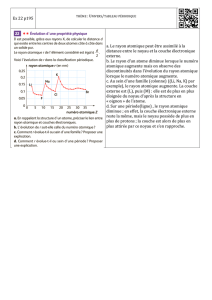
Activité : Interprétation de l`évolution des rayons atomiques et

Chapitre 1: La classification périodique des éléments Activité
Activité : Interprétation de l’évolution des rayons atomiques et
ioniques dans le tableau périodique
Document 1 : Variation du rayon atomique en fonction du numéro atomique Z
Document 2 : Comparaison des rayons ioniques et atomiques de quelques éléments (rayons en pm)
1PCSI, lycée de l’Essouriau, 2014/2015

Chapitre 1: La classification périodique des éléments Activité
Document 2 : La notion de nombre de charges effectif Zef f
Tout en étant attiré par le noyau, chaque électron d’un atome polyélectronique est repoussé par les autres élec-
trons présents. Il en résulte qu’il est lié moins étroitement au noyau que si ces autres électrons étaient absents.
Nous disons que chaque électron est blindé contre l’attraction complète du noyau par effet d’écrantage des
autres électrons de l’atome (vois la figure ci-dessous). La charge nucléaire effective Zef f e(e la charge électrique
élémentaire) correspond à la charge effectivement "ressentie" par l’électron considéré et est toujours inférieure
à la charge nucléaire réelle Ze parce que les répulsions entre les électrons agissent contre l’attraction du noyau.
Document 3 : Evolution du nombre de charge effectif en fonction du numéro atomique
Document 4 : Loi de Coulomb
2PCSI, lycée de l’Essouriau, 2014/2015

Chapitre 1: La classification périodique des éléments Activité
Document 5 : Densité de probabilité de présence d’un électron autour du noyau dans les couches 1s, 2s et
3s
1. Préciser comment évolue le rayon atomique le long d’une colonne de la classification périodique ? Le long
d’une période ?
2. Expliquer en quoi le document 5 permet d’interpréter l’évolution du rayon atomique selon une colonne du
tableau périodique. On pourra choisir un exemple.
3. Evolution du rayon atomique selon une période.
(a) Donner la configuration électronique du magnésium et du sodium. Le document 5 permet-il d’expliquer
les différences de rayon atomique ?
(b) On s’intéresse à un électron de la couche externe du sodium et du magnésium. Proposer un modèle
simple de la structure atomique de ces deux atomes faisant intervenir le nombre de charges effectif.
(c) Comparer qualitativement la force de Coulomb qui s’exerce entre un électron de la couche externe du
sodium et son noyau, avec la force qui s’exerce entre un électron de la couche externe du magnésium
et son noyau. Expliquer alors la différence de rayon atomique entre ces deux éléments.
(d) Expliquer l’évolution du rayon atomique le long d’une période du tableau périodique.
4. Comparaison des rayons atomique et ionique.
(a) Préciser comment évolue le rayon ionique par rapport au rayon atomique.
(b) Expliquer les variations de rayon entre Li+et Li.
3PCSI, lycée de l’Essouriau, 2014/2015
1
/
3
100%