de la souris Développement précoce divergence des - iPubli

LEXIQUE EMBRYOLOGIE
1991 7 962-4
·
priori
••.
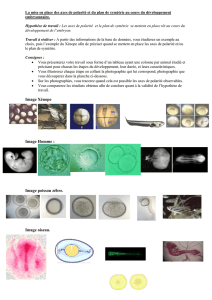
igure 1).
in
vitro
igure 2) ,
s n °

Oh
48 h
60 h
12 h
24 h
72 h
84 h
36 h 48 h
4
96 h
0
16,
2.
°

1
/
3
100%