Établissement des axes embryonnaires au cours du développement

M/S n°21, vol. 18, février 2002 193
REVUES
SYNTHÈSE
Une des questions centrales de la biologie du dévelop-
pement contemporaine est la nature moléculaire de l’in-
formation conduisant les cellules de l'embryon précoce
vers un devenir particulier. Un bon modèle animal utilisé
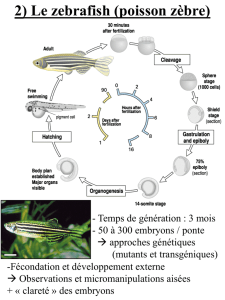
pour répondre à cette question est le poisson zèbre
(Danio rerio). Ce modèle présente en effet un certain
nombre d’avantages : il permet une analyse génétique
(grande collection de mutants, stratégies d’analyse du
génome en plein essor) ainsi qu'une approche embryolo-
gique classique facilitée par la transparence des
embryons et leur développement très rapide (gastrula-
tion après 5 h de développement).
Après fécondation, la
première cellule, située
au sommet d'une gran-
de réserve vitelline, va subir une succession de divisions
synchrones, conduisant à un ensemble de cellules iden-
tiques et totipotentes. Jusqu'au stade de transition mi-
blastuléenne (1 024 cellules), le développement s'effec-
tue sous contrôle de l'information maternelle. Ce n'est
qu'à partir de ce stade que le génome zygotique com-
mence à être transcrit. Les cellules, situées toutes au
pôle animal*, vont commencer à se diviser de manière
asynchrone puis vont progressivement recouvrir la réser-
ve vitelline* au cours du mouvement d’épibolie*. La
gastrulation commence lorsque 50 % du vitellus est
recouvert par les cellules embryonnaires. À partir de ce
stade, trois mouvements sont à considérer : le mouve-
ment d'épibolie* qui se poursuit jusqu'à ce que toute la
réserve vitelline soit recouverte par les cellules
embryonnaires, le mouvement d'invagination des cel-
lules de la marge (Figure 1) qui va permettre la forma-
tion des deux feuillets embryonnaires profonds, l’endo-
derme et le mésoderme, et le mouvement de convergen-
ce qui conduit les cellules ventrales vers la face dorsale
de l’embryon où s'allonge l'axe embryonnaire [1].
C'est immédiatement après la transition mi-blastuléenne
qu'une cascade d’événements moléculaires va progressi-
Établissement
des axes
embryonnaires
au cours du
développement
du poisson zèbre
Bernard Thisse, Christine Thisse
>La définition des axes embryonnaires au cours
du développement du poisson zèbre s'effectue
au stade blastula. L'embryon consiste alors en
une couche de cellules recouvrant le vitellus. Les
cellules, initialement toutes identiques, vont
progressivement acquérir une identité propre en
fonction de leurs coordonnées spatiales (dorso-
ventrale et antéro-postérieure) dans l'embryon.
Ces coordonnées sont définies via deux gradients
d’activité de molécules sécrétées appartenant à
la superfamille des TGFβ: les bone morphogene-
tic protein (BMP, pour l’axe D/V) et les facteurs
activine et nodal (pour l’axe A/P). Ces gradients
d'activité sont finement réglés par des facteurs
sécrétés agissant comme des inhibiteurs.
L'activité des BMP est contrôlée au niveau de son
expression via les FGF (FGF8) ainsi que par noggin
et chordin qui se fixent sur les BMP et les empê-
chent de stimuler leur récepteur spécifique. Pour
les facteurs activine et nodal, l'activité est
réglée par un autre TGFβ(antivin) qui agit
comme un inhibiteur compétitif de la fixation de
ces ligands sur leur récepteur. Les recherches
actuelles et futures visent à examiner les inter-
actions entre ces voies ainsi qu’avec d’autres
voies de signalisation impliquées lors de l’em-
bryogenèse précoce : les Wnt et les rétinoïdes. <
MEDECINE/SCIENCES 2002 ; 18 : 193-204
B. Thisse, C. Thisse :
Institut de Génétique et de
Biologie Moléculaire et
Cellulaire,
Cnrs/Inserm/ULP,
1, rue Laurent Fries, BP 163,
CU de Strasbourg,
67404 Illkirch Cedex, France.
* Voir Glossaire.
Article disponible sur le site http://www.medecinesciences.org ou http://dx.doi.org/10.1051/medsci/2002182193

M/S n°21, vol. 18, février 2002
194
l’activité de molécules sécrétées, appartenant à la superfamille des
TGFβ: les BMP (bone morphogenetic proteins) (pour revue voir [5]).
Chez le poisson zèbre, ces facteurs BMP sont exprimés très précocement
dans les territoires ventraux et ventro-latéraux de l'embryon et confè-
rent aux cellules qu'ils stimulent une identité ventrale [6-9]. Ainsi, par
vement conduire les cellules de l'embryon à adopter un
devenir particulier tel qu'on peut le définir sur la carte des
territoires présomptifs établie à la fin du stade blastula
(Figure 1B). À ce stade, les cellules embryonnaires for-
ment une couche unique recouvrant l'hémisphère animal
du vitellus. Par analogie avec le système de coordonnées
utilisé pour définir une position sur le globe terrestre on
peut caractériser le devenir d'une cellule donnée en fin de
stade blastula en fonction de deux coordonnées : sa lon-
gitude, qui correspond à la position de cette cellule de
long de l’axe dorso-ventral (D/V, avec pour méridien
d'origine l'axe embryonnaire qui se forme dorsalement) et
sa latitude qui correspond à la position de cette même
cellule le long de l’axe margino-animal (Figure 1B).
L’axe dorso/ventral : les BMP et leurs inhibiteurs
De manière générale, les méthodologies employées pour
perturber la formation des axes embryonnaires sont soit
« la perte de fonction » d’éléments requis pour la for-
mation de ces axes, via par exemple la genèse de mu-
tations après mutagenèse ENU (éthyl-nitroso-urée) [2,
3] ou en inhibant la fonction des gènes d’intêret par la
technique de morpholino knock-down [4], soit au
contraire en réalisant des expériences dites « gain de
fonction » via la surexpression de facteurs par injection
d’ARN dans des embryons à des stades très précoces de
développement.
Chez le xénope, des études antérieures ont montré que
l’identité des cellules le long de l’axe D/V dépend de
Figure 1. Carte des territoires présomptifs d’un embryon de
poisson zèbre au stade de blastula tardive. A. Les cellules
embryonnaires sont disposées sur l'hémisphère animal de la
réserve vitelline. Le mouvement d’épibolie conduit les cellules
de la marge jusqu'au niveau de l’équateur. PA : pôle animal ;
PV : pôle végétal ; D : dorsal ; V : ventral. B. Carte des terri-
toires présomptifs de l’embryon au même stade qu'en A (5h de
développement, d’après [54, 55]). La région marginale com-
prend des cellules endodermiques, les cellules mésodermiques
incluant la plaque préchordale (pp), la notochorde (Not), les
muscles et le territoire sanguin. Au niveau de l’ectoderme, on
distingue la moelle épinière ou corde spinale (C. sp), le rhom-
bencéphale (Rhomb), le mésencéphale (Més), le diencéphale
(Di), le télencéphale (Tél) et l’épiderme (Épi). Le devenir de
chaque cellule peut être défini selon ses coordonnées (flèches
rouges) : sa longitude (le long de l’ave D/V) et sa latitude (le
long de l’axe marge/pôle animal ou antéro-postérieur, A/P).
C. Structures dérivant des territoires présomptifs décrits en B.
Même code couleur. La glande d'éclosion (Gl) dérive de la
plaque préchordale.
Di
Més
Rhomb
C.sp
Sang Muscles
Not
Épi
Marge
(endoderme
+ mésoderme)
Tél
Endoderme/pp
Vitellus
A
B
C
D
V
PA
PV
Marge
Vitellus
Tél
Més
Rhomb
C.sp
Not
Muscles
Sang
Gl. éclosion

M/S n°21, vol. 18, février 2002 195
REVUES
SYNTHÈSE
rapport à la situation sauvage (Figure 2A), manipuler l'axe
D/V revient à modifier la dose de BMP que vont recevoir les
cellules de la blastula. On va ainsi obtenir deux types de
phénotypes : un phénotype de dorsalisation (Figure 2B) ou
un phénotype de ventralisation (Figure 2C). Le phénotype
de dorsalisation (Figure 2B) résulte de la perte d'activité
des BMP (mutation ou inactivation des gènes codant pour
ces facteurs ou surexpression d'inhibiteurs spécifiques).
Par rapport à la situation sauvage, on observe, chez les
embryons dorsalisés, un élargissement des territoires
dorso-latéraux tant au niveau du feuillet mésodermique
que du feuillet ectodermique (Figure 2B). Les embryons ont
une forme allongée, d’où le nom par exemple de la mutation
aubergine qui inactive le gène BMP7 [9]. Au niveau de la
couche mésodermique, le territoire somitique (musculaire)
s'élargit au détriment du mésoderme ventral (sang) et,
dans les cas extrêmes, les sillons somitiques font tout le
tour de l'embryon. Pour l'ectoderme, les mêmes élargisse-
ments et circularisations des territoires dorso-latéraux
sont observés avec une disparition concomitante de l'épi-
derme (Figure 2B). À l'opposé, la surexpression des BMP
induit un phénotype de ventralisation consistant en un
élargissement du territoire mésodermique ventral hémato-
poïétique, au détriment du mésoderme dorsal, notochordal
(Figure 2C). Dans l’ectoderme, l'expansion de l'épiderme au
détriment du neurectoderme (future plaque neurale)
conduit à une réduction voire à une disparition totale du
cerveau (Figure 2C).
Plusieurs membres de la famille des BMP, BMP2b, BMP4
et BMP7 présentent des activités biologiques équiva-
lentes [10, 11]. Les mutants de BMP2b (swirl) [8] ou de
BMP7 (aubergine/snailhouse) [9] conduisent à des phé-
notypes identiques de dorsalisation extrême. Le double
mutant BMP2b/BMP7 ne présente pas de phénotype
additionnel. Ces deux facteurs ne peuvent donc pas se
substituer l'un à l'autre puisque la présence d'un gène
BMP2b fonctionnel chez le mutant aubergine n'empêche
pas la perte des territoires ventraux de l'embryon.
Par des expériences d'injection d'ARN, on a montré que
BMP2b et BMP7 agissent de manière synergique lorsque
les deux transcrits sont exprimés dans la même cellule.
Leur action coopérative, probablement sous la forme
d'hétérodimères, augmente de façon spectaculaire leur
activité comparée à celle d’un monomère seul [9]. Ceci
montre que l’établissement de l’axe D/V ne dépend pas
de l’activité de monomères de BMP mais résulte de l’ac-
tion d'hétérodimères BMP2b/BMP7.
Modulation de l'activité des BMP
Différents facteurs inhibiteurs des BMP, tels que Noggin,
Chordin et Follistatin ont été identifiés chez le xénope
[12-14]. Ces facteurs sécrétés agissent en se liant aux
Figure 2. Le profil embryonnaire le long de l’axe D/V dépend de
l’activité des BMP. A. Situation sauvage. À gauche, carte des
territoires présomptifs en fin de stade blastula. Épi : épiderme;
Rh : rhombencéphale. À droite, vue latérale d’un embryon à
36 h de développement. B. (-BMP) Phénotype de dorsalisation
obtenu après inhibition de la voie des BMP. Sur la carte des ter-
ritoires présomptifs, le territoire somitique (muscles) apparaît
élargi au détriment du mésoderme ventral (sang). Le cerveau
est élargi au détriment de l’épiderme (Épi). Ceci est visualisé
après analyse par hybridation in situ avec le marqueur muscu-
laire MyoD qui révèle une circularisation des somites ou avec
Krox20, spécifique des rhombomères 3 et 5 (Rh) montrant éga-
lement une circularisation de ces structures neuroectoder-
miques chez l’embryon dorsalisé. [+] Expression des mêmes
marqueurs chez l'embryon sauvage. C. (+BMP) A l’opposé, une
surexpression des BMP induit un phénotype de ventralisation.
On observe dans le mésoderme un élargissement des territoires
ventraux (sanguins) avec une disparition des territoires les
plus dorsaux (notochorde). Dans l’ectoderme, on observe une
expansion de l’épiderme et une forte réduction du cerveau. Ces
altérations sont visibles sur la carte des territoires présomptifs
à gauche, ou à droite chez un embryon en vue latérale : la par-
tie céphalique est absente et la quantité de sang apparaît plus
abondante comparée au témoin sauvage en A.
Sang
Sang
Muscles
Rh
Épi
Épi
SAUVAGE
+ BMP
Sang
Muscles
Rh Rh
Muscles
- BMP
[+]
A
B
C

M/S n°21, vol. 18, février 2002
196
BMP, les empêchant ainsi de se fixer et de stimuler leurs
récepteurs spécifiques (pour revue voir [5, 15, 16]). Un
gène chordin a été caractérisé chez le poisson zèbre et
le mutant de ce gène conduit à un phénotype de ventra-
lisation, résultant de la perte de son activité antago-
niste des BMP [17]. Par une approche biochimique, il a
été montré qu’une métalloprotéase, Tolloid, ou son
homologue, Xolloid, chez le xénope, contrôle négative-
ment l’activité de Chordin par clivage, restaurant ainsi
l’activité BMP [18, 19]. Chez le poisson zèbre, les
mutants de tolloid conduisent à des phénotypes de dor-
salisation qui résultent de l'augmentation d'activité de
Chordin et donc de la diminution de l'activité des BMP
[20].
Alors qu’une seule copie de noggin et follistatin a été
isolée dans différentes espèces [12, 14], chez le pois-
son zèbre trois gènes noggin ont été caractérisés [21,
22] ainsi que deux gènes follistatin. L’un de ces gènes,
noggin1, est exprimé comme le gène noggin de xénope à
la marge dorsale de l’embryon, dès le stade blastula.
Comme dans d’autres espèces, la surexpression de nog-
gin1 inhibe l’activité des BMP. En ce qui concerne les
gènes follistatin, leur surexpression entraîne une inac-
tivation des BMP. Cependant, ces gènes s'expriment trop
tard au cours du développement du poisson zèbre pour
jouer un rôle dans l'établissement de l'axe D/V.
Enfin, par une analyse génétique, une mutation ogon a
été isolée et code pour un nouveau gène qui possède des
propriétés inhibitrices de l'activité des BMP [23].
La régulation de l'activité morphogénique des BMP ne se
limite pas à l'interaction avec des facteurs inhibiteurs
sécrétés par les régions dorsales de l'embryon de pois-
son zèbre, tels que chordin, noggin1 ou ogon. En effet,
un autre niveau de contrôle de l'activité de ces gènes a
été mis en évidence, situé au niveau du contrôle de leur
expression. Les gènes BMP (BMP2b et BMP7) sont initia-
lement exprimés dans toutes les cellules de la blastula,
puis les transcrits disparaissent progressivement des
territoires dorsaux. Le contrôle de cette expression est
effectué par les FGF et en particulier par le FGF8 [24]. Ce
facteur fibroblastique de croissance avait été précé-
demment décrit dans d'autres espèces comme une
molécule signal impliquée dans la croissance du bour-
geon de membre [25] ainsi que dans le développement
du cerveau moyen [26]. Chez le poisson zèbre, ce gène
est exprimé très précocement à la marge de la blastula
puis sous la forme d'un gradient dorso-ventral dans la
région marginale de la gastrula, ce qui suggère qu’il
puisse être impliqué dans l'axogenèse D/V. De fait, l'ex-
pression ectopique du FGF8 induit une gamme de
Figure 3. Manipulations de l'axe D/V via le contrôle de l'activité morphogénique des BMP. A. Section d'un embryon suivant l'axe D/V au stade gas-
trula permettant de mettre en évidence l'organisation des tissus mésodermiques et ectodermiques le long de cet axe. On peut ainsi distinguer les
territoires dorsaux (D, en rouge) comprenant la notochorde dans le feuillet mésodermique, la plaque basale du tube neural et les neurones moteurs
dans l'ectoderme ; les territoires dorsaux latéraux (DL, en jaune) comprenant les muscles pour le mésoderme, les inter-neurones pour l'ectoder-
me ; les territoires ventraux latéraux (VL, en bleu) comprenant le pronéphros pour le mésoderme ; les neurones dorsaux et les crêtes neurales pour
l'ectoderme ; les territoires ventraux (V, en rose) comprenant le sang pour le mésoderme et l'épiderme pour le feuillet ectodermique. Le croissant
vert représente le gradient d'expression du FGF8 au stade gastrula. On peut définir les différents territoires le long de l'axe D/V en fonction d'une
valeur de position dorsale. Selon ce modèle, les différents territoires sont formés en réponse à la valeur de position dorsale que mesure chaque cel-
lule le long de l'axe D/V. L'information positionnelle dorsale, nulle sur la face ventrale de l'embryon et maximale sur la face dorsale (courbe rouge)
représente la résultante de l'interaction entre les BMP ventralement et leurs inhibiteurs dorsaux. En fonction de la valeur de cette information de
position, les cellules vont adopter un sort ventral (rose), ventro-latéral (bleu), dorso-latéral (jaune) ou dorsal (rouge). La pertinence de ce modè-
le est illustrée par l'étude de l'inhibition de l'expression des BMP par le FGF8 dans des expériences de surexpression. La surface verte sur ce graphe
correspond à la contribution du FGF8 à l'établissement de l'axe D/V (fondé sur son territoire d'expression dorsal et dorso-latéral, ainsi que sur son
activité biologique : capable d'induire des structures dorso-latérales mais incapables d'induire les sorts les plus dorsaux). B. Lorsque l'embryon
est saturé en FGF8 (injection d'ARN sens au stade une cellule), l'expression des BMP est réprimée dans tout l'embryon et en conséquence toutes les
cellules adoptent un sort dorso-latéral caractérisé par la circularisation du territoire musculaire (embryon du haut) ou des rhombomères (Rhomb)
du cerveau postérieur (embryon du bas). Ce phénotype est identique au phénotype de perte de fonction des BMP présenté en figure 2B. En pareil
cas, la courbe de l'information positionnelle (rouge) est déplacée vers les valeurs correspondant aux territoires dorso-latéraux pour toutes les cel-
lules à l'exception de celles des territoires dorsaux endogènes. C. Lorsque le clone sécrétant le FGF8 est en position latérale on observe un élargis-
sement des territoires dorso-latéraux tant dans le mésoderme (élargissement unilatéral des sillons somitiques) que dans l'ectoderme (élargisse-
ment unilatéral de la plaque neurale bordée par les cellules des crêtes neurales ; augmentation unilatérale du nombre d'inter-neurones).
D. Lorsque le clone est en position ventrale, il conduit à la formation d'un axe secondaire partiellement défectif comprenant les territoires dorso-
latéraux mais pas les territoires dorsaux (notochorde et partie ventrale du tube neural). L'embryon du haut est photographié sous ses deux faces,
dorsale (axe endogène) et ventrale (axe induit). Les mêmes résultats peuvent être observés en inhibant l'activité des BMP par la surexpression
d'autres facteurs inhibiteurs qui tels Noggin et Chordin agissent en fixant les BMP les empêchant ainsi de stimuler leur récepteur spécifique.

M/S n°21, vol. 18, février 2002 197
REVUES
SYNTHÈSE
A
B C D
Valeur de position
dorsale
Notochorde, Plaque basale,
Neurones moteurs
Muscles
Inter-neurones
Pron., Neur. d, Crêtes neurales
Sang
Épiderme FGF8
DV
VVLDLD
Épiderme
Pronéphros
Muscles
FGF
Plaque basale
Neurones
moteurs
Inter-neurones
Notochorde
Neurones
dorsaux +
crêtes neurales
Ventral Dorsal
FGF8
(endogène)
DL D V VL DL D
FGF8
(exogène)
DL VL V DVL DL
Crêtes neurales
Muscles
Rhomb.
Neurones moteursInter-neurones
Crêtes neurales
Crêtes neurales
Muscles
Axe endogèneAxe induit
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%