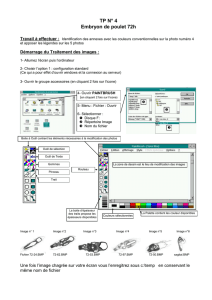
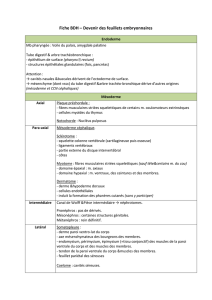
cours 4 master BioDev

2) Le zebrafish (poisson zèbre)
- Temps de génération : 3 mois
- 50 à 300 embryons / ponte
approches génétiques
(mutants et transgéniques)
-Fécondation et développement externe
Observations et micromanipulations aisées
+ « clareté » des embryons

Le génome du zebrafish
- 25 chromosomes (tous autosomes ! Pas de
chromosome sexuel)
- environ 1,5 Giga-bases (1, 5 109 bases)
- début du séquençage en 2001;
Voir publication : « The zebrafish reference genome sequence and its
relationship to the human genome” Nature 2013
1,412,464,843 paires de bases (Zv9)
environ 26.206 gènes (codant pour des protéines)
voir sites internet :
NCBI: http://www.ncbi.nlm.nih.gov/genome/guide/zebrafish/index.html
UCSC : http://genome.ucsc.edu/
Ensembl : http://www.ensembl.org
(annotation « automatique »)
Vega : http://vega.sanger.ac.uk/Danio_rerio/
(annotation vérifiée)
-Centre de distribution de clones (cDNA ou gDNA)
(pour toutes les espèces) :
ImaGenes : http://www.imagenes-bio.de/


3400 gènes dupliqués chez le
zebrafish : paralogues
Cause : duplication du génome durant l’évolution des téléostéens
(environ 300 millions d’années)
HB 48 hpf 48 hpf
Exemple : le gène Pax6
Pax6a Pax6b
HB
26 hpf 26 hpf
Vues latérales
Pax6a exprimé
dans les yeux,
SNC, cerveau
postérieur (HB)
Pax6b exprimé
dans les yeux,
SNC et le
pancréas
expression différente : partage de la fonction du gène ancestral
« subfonctionalisation »

Comparaison des séquences génomiques entre
les gènes paralogues (et entre orthologues)
: exon
: région non transcrite conservée
Lignée transgénique P0Pax6:GFP
Chr.25
Chr.7
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%