correction

Graphe 1
Graphe
2
Graphe
3
SECONDE
DES ETOILES DE TOUTES LES COULEURS
1- Le SOLEIL est une étoile Jaune, RIGEL est une étoile bleue et BETELGEUSE est une étoile rouge.
Compléter le tableau suivant en complétant uniquement la colonne étoile et couleur.
ETOILE COULEUR TEMPERATURE
(K) 1/T Graphe n° λ
max(nm)[1] λ
max(nm)[2]
BETELGEUSE Rouge 3600 2.78 x10
-
4
1 800 810
SOLEIL Jaune 5800 1.72 x 10
-
4
3 560 520
RIGEL Bleu 10000 1.00x10
-
4
2 300 290
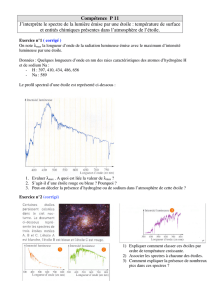
2- Soit les spectres de ces 3 étoiles superposés avec la courbe théorique de corps noir correspondante :
graphe1,2 et 3= intensité lumineuse en fonction de la longueur d’onde en nm.
a. Indiquer sur ces graphes les limites de longueur d’onde du spectre visible, indiquer également où se trouve les
ultraviolets (UV) et les infrarouges (IR)
b. En observant à quelle longueur d’onde l’intensité lumineuse est maximum dans le visible, en déduire à quelle étoile
correspond chaque graphe et compléter le tableau
(colonne graphe n°)
c. Tracer sur chaque graphe un trait permettant de mesurer
la longueur d’onde où l’émission est maximum λmax et
compléter le tableau (colonne λmax[1])
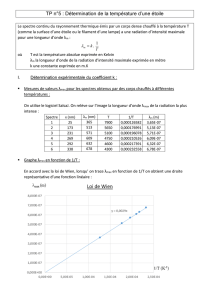
3- La loi de WIEN permet de trouver une relation entre
la longueur d’onde du maximum d’émission et la
température. Le graphe 4 donne λmax en fonction de
1/T.
a. Compléter la colonne 1/T du tableau (3 chiffres
significatifs et notation scientifique)
b. sur le graphe 4, tracer les traits nécessaires pour
retrouver les valeurs de λmax pour chaque étoile.
Compléter ensuite la colonne λmax[2]).
c. Trouver graphiquement le coefficient directeur k de la
droite et en déduire que la loi de Wien peut s’exprimer
sous la forme : λmaxxT = k
( rappel : pour une droite y = ax + b le coefficient
directeur se mesure en calculant y2-y1
x2-x1)
k = 870-430
3x10-4-1.5x10-4 =440
1.5x10-4 = 2.93 x106
donc λmax= k x 1/T λmax x T = k
ContrôledePHYSIQUE
Graphe 4
(0.75pt)
(1 pt)
(0.5pt)
(1.5 pt)
(1pt)
(1.5 pt)
(2 pts)
visible
visible
visible
UV
UV
λ
max
IR
IR
IR
UV
λ
max
λ
max
810 nm
290 nm
520 nm

Rigel
Soleil
Betelgeuse
1Å =10-10m
d. A l’aide de la loi de Wien λmaxxT = 2.89 x106, Calculer la valeur exacte (avec 3 chiffres significatifs) de la
longueur d’onde d’émission maximum du Soleil.
4- Les documents ci-contre montrent les spectres de ces 3
étoiles entre 5890Å et 5910 Å (rappel 1 Å = 0.1 nm)
a. Exprimer l’Angstrøm sous forme d’une
puissance de dix en m
b. Ces spectres d’étoile sont-ils des
spectres d’émission ou d’absorption ?
Expliquer pourquoi
c. Les 2 raies les plus intenses sur ces graphes sont celles du Sodium
(Na), Les indiquer par un trait sur les 3 graphes. Trouver la
longueur d’onde de ces 2 raies en nm avec 4 chiffres significatifs.
d. Une des raies du fer a une longueur d’onde λ=588.38 nm. Le fer
est-il présent dans l’atmosphère de ces 3 étoiles.
5- Le sodium est aussi présent sur Terre mais toujours sous
forme ionique. Son numéro atomique est Z=11.
a. Donner sa structure électronique et montrer qu’il formera l’ion Na+
.
Indiquer la demi-equation électronique correspondante.
b-Le sodium s’associe avec des ions négatifs pour former des composés
ioniques compléter le tableau suivant :
composé Etat solide En solution
Sulfate de sodium Na2SO42Na
+
+ SO4
2
-
Phosphate de sodium Na2PO43Na
+
+ PO4
3
-
Hydroxyde de sodium NaHO Na
+
+ HO
-
(Les 3 ions négatifs sont dans le désordre : HO-, SO42- PO43-)
6- a)Le fer peut former deux sortes d’ions : l’ion ferII : Fe2+ ou l’ion fer III Fe3+. Compléter le tableau
suivant :
Composé solide solution composé solide solution
Oxyde de ferIII. Fe2O32Fe3++ 3O2- Sulfate de fer II FeSO4Fe2++ SO42-
Sulfate de fer III Fe2(SO4)22Fe3++ 3 SO42- Phosphate de fer
II Fe3(PO4)23Fe2++ 2PO43-
Chlorure de fer
II FeCl2Fe2++ 2Cl-Nitrate de fer III Fe(NO3)3Fe2++ 3 NO3-
(Ions négatifs : NO3
-, SO42-, Cl-, PO43-, O2-)
b) Si on verse de la soude contenant des ions hydroxyde HO-sur une solution contenant des ions fer III on
obtient un précipité orange d’hydroxyde de fer III. Ecrire l’équation-bilan de cette précipitation.
λmaxxT = 2.89 x106donc λmax =
2.89
x
10
6
T= 2.89 x106/5800 = 498 nm
Raie d’absorption : les raies indiquent des intensités de lumière faibles
donc manquantes. L’atmosphère d’une étoile absorbe des radiations
caractéristiques des éléments qui la composent
λ1=589.0 nm λ1=589.6 nm
Raie présente pour le Soleil et Betelgeuse mais très peu
visible pour Rigel
Na : K2L1 : 1 électron sur le dernier niveau. Il formera donc l’ion
Na+en perdant cet électron
Na Na++ 1e
(1 pt)
(0.25pt)
(1 pt)
(1 pt)
(1 pt)
(2 pts)
(1.5pt)
(3 pts)
(1 pt)
Fe3 ++ 3 HO-Fe(OH)3
fer
fer
1
/
2
100%