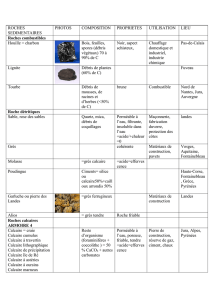
Etude du calcaire d`un sable

Eau, dissolution, concrétion
Mots clés : Erosion, dissolution, concrétion. Surveillance et lutte contre les pollutions. Ressources
minérales dans les océans.
Objectifs : connaître les formes du calcium, lier avec les ions contenant du carbone
1. Mise en perspective : géologie.
1. Question ; quel élément chimique est caché
derrière ces mot-clé ?
Coup de pouce : on donne d’abord les éléments de
vocabulaire autour de cet élément chimique :
calcaire, calcium, carbonate de calcium.
2. Donner une idée du cycle de cet élément
chimique dans la biosphère, à partir des
documents.
3. Dans cette représentation placer les mots :
tartre, précipité…
2. Expérience simple : dissolution du calcaire
4. Les documents montrent que les eaux de ruissellement dissolvent le calcaire, comment
illustrer au laboratoire cette dissolution. Comment la rendre plus rapide, plus efficace ?
3. Manipulation : mise en évidence du calcaire dans le sable de la
plage de la Terrière (85).
Observer le sable à la loupe binoculaire identifier silice, silex, et des grains sombres ou jaunes.
Verser une micro goutte d’acide chlorhydrique sur le sable
5. Observer,
6. Conclure.
7. .
Quel produit de cette dissolution est gazeux.
8. Proposer une traduction de cette réaction en français, et sous forme d’équation bilan.
4. Recherche personnelle, conclusion.
9. Pour sa semaine à venir préparer un court paragraphe sur le rôle de l’eau dans la formation
du sable. Prévoir d’envisager les aspects mécanique et chimique.
10. Vues la formation, la formule du calcaire quel lien entre les cycles du carbone et du calcium ?
11. Tenter une représentation de ces deux cycles.
12. Justifier le rôle de piège à carbone des roches calcaires et des océans.
L’équilibre des différentes formes du carbone doit être gardé pour plus tard dans un autre tp.
5. Méthode de mesure du taux de calcaire dans un sol, découverte.
13. Proposer une méthode de test qualitatif de la présence de calcaire dans un sol.
14. Comment rendre cette méthode quantitative ?
15. Donner une définition possible pour le taux de calcaire d’un sol.
6. Manipulation, mesure du taux de calcaire du sable ;
Schéma du montage :
Au lycée, un flacon à gaz est empli de 50mL d’acide chlorhydrique concentré (lunettes, gants), on
introduit une masse de sable pesé dans une poche de papier absorbant.
On ferme vite, le gaz est recueilli dans un tube par déplacement d’eau.
7. Exploitation des mesures
Rappel le volume d’une mole de gaz dans les conditions normales de température est 24L/mol.
Le volume de CO2 dégagé est V=______mL.
16. En déduire le nombre de mol de CO
2
.
17. Montrer que le nombre de mol de dioxyde de carbone correspond au nombre de mol de
calcaire.
18. La masse molaire du calcaire est 100g/mol, en déduire la masse de calcaire.
19. Calculer le taux de calcaire, c'est-à-dire le pourcentage en masse.

Eau, d
Corrigé
1. Géologie
1. L’
élément chimique est le calcium
le calcaire ou carbonate de calcium CaCO
ionique. Un arrangement régulier d
Précision :
le 3 est là pour l
atomique.
Une représentation du cristal de calcaire.
2. Le cycle du calcium
Le calcaire est formé dans l’
eau par les
CaCO
HCOCa
3
2
2=+
−
+
La réaction inverse participe de l
soi
t naturellement soit après lessivage d
Une autre
illustration est le précipité (trouble) de l
simplifiée
+
+COCa
2
2
précipité.
La version anglophone :
Calcium carbonate will react with water that is saturated with carbon
dioxide to form the soluble
calcium bicarbonate
CaCO
3
+ CO
2
+ H
2
O
This reaction is important in the
hard water in many regions.
3. Le tartr
e, dentaire ou non est un
4.
Pour accélérer la réaction chimique, force est d
concentration
des solutions en réactifs
2. Calcaire
dans le sable vendéen.
5. Observation
On voit
des grains vitreux (silice) des grains noirs
silex ? La
forme des grains tient à leur dureté, plus la roche est anguleuse plus elle est dure.
Eau, d
issolution, concrétion
8. Prolongement : l
e grès
du sable
Falaise de grès de la plage d
’A
Estremadura, Portugal.
Le grès est le résultat de la cimentation de grains de
sable, c’est une roche
détritique Une roche détritique
contient au moins 50% de débr
ou d’organisme vivants.
élément chimique est le calcium
Ca
40
20
il est un composant des roches sédimentaires dans
le calcaire ou carbonate de calcium CaCO
3
. Il ne s’agit pas d’
une molécule, plutô
ionique. Un arrangement régulier d
’ions de signe opposés : l’
ion carbonate
le 3 est là pour l
’élément oxygène, le 2-
est la charge globale de l
Une représentation du cristal de calcaire.
eau par les
foraminifères, qui réalisent la réaction
OHCO
CaCO
223
++
La réaction inverse participe de l
’
érosion, le calcium retourne en solution. Les eaux
t naturellement soit après lessivage d
’effluents industriels
, on parle de pluies acides.
illustration est le précipité (trouble) de l
’
eau de chaux, qui correspond à la réaction
+
+=+ HCaCOOH 2
32
le calcaire solide apparait comme un
Calcium carbonate will react with water that is saturated with carbon
calcium bicarbonate
.
O
→ Ca(HCO
3
)
2
This reaction is important in the
erosion of carbonate rocks, forming
caverns
e, dentaire ou non est un
précipité de carbonate de calcium.
Pour accélérer la réaction chimique, force est d
’utiliser une solution d’
acide concentrée, la
des solutions en réactifs
est un facteur cinétique.
dans le sable vendéen.
des grains vitreux (silice) des grains noirs
?
, des grains jaunes (cacaire) des grains bruns
forme des grains tient à leur dureté, plus la roche est anguleuse plus elle est dure.
e grès
, devenir
’A
lmagreira, Péniche
Le grès est le résultat de la cimentation de grains de
détritique Une roche détritique
contient au moins 50% de débr
is, issus de l’érosion
il est un composant des roches sédimentaires dans
une molécule, plutô
t d’un cristal
ion carbonate
−2
3
CO
.
est la charge globale de l
’ion poly
foraminifères, qui réalisent la réaction
érosion, le calcium retourne en solution. Les eaux
sont acides
, on parle de pluies acides.
eau de chaux, qui correspond à la réaction
le calcaire solide apparait comme un
Calcium carbonate will react with water that is saturated with carbon
caverns
, and leads to
acide concentrée, la
, des grains jaunes (cacaire) des grains bruns
forme des grains tient à leur dureté, plus la roche est anguleuse plus elle est dure.

Eau, dissolution, concrétion
Action des ions H
3
O
+
Les ions oxonium réagissent avec le calcaire mais pas avec le quartz et autres matériaux siliceux.
On voit donc des grains isolés danser sur une mousse de bulles de dioxyde de carbone.
6. Conclusion le sable est brassé mécaniquement les grains se frottent, et l’eau dissous le
calcaire, la part de matériau dur, et insoluble augmente.
7. Le produit est le dioxyde de carbone, forme gazeuse du carbone, présent à raison de 0,03%
dans l’atmosphère et atome central des édifices vivants.
8. Le calcaire réagit avec les ions oxonium pour donner de l’eau, du dioxyde de carbone gazeux
et des ions calcium.
OHCOCaOHCaCO
22
2
33
32 ++=+
++
La réaction a servit aussi à lutter contre l’acidification des eaux, par addition de calcaire (en
anglais liming).
9. Au boulot
10. Les cycles du carbone et du calcium se touchent avec les composés : calcaire
3
CaCO
,
Bicarbonate de calcium
23
)(HCOCa
,
11. Balèze
12. Les roches calcaires immobilisent le carbone dans la structure, donc il n’est pas dans
l’atmosphère sous forme gazeuse.
3. Taux de calcaire d’un sol.
13. On verse de l’acide, si cela bulle a priori c’est du CO2 donc le calcaire est présent.
14. On mesure le volume de gaz produit en rapport avec la masse de terre, (sable).
15. Le taux de calcaire peut être le rapport masse de calcaire sur masse totale, sans unité, en %.
4. Manipulation quantitative
Il est nécessaire que l’acide soit en excès pour que tout le calcaire réagisse.
Calcul du nombre de mol, exemple ;
µmol
LL
VV
n
molaire
520
24
10.13
3
===
−
Calcul de la masse de calcaire
.52100.10.520.
6
mgMnm ===
−
On peut aussi utiliser le tableau de proportionnalité
Masse de calcaire Volume de CO2 Nombre de mol
0,1g 24mL 1 mmol
Le pourcentage massique est le rapport
%5
21,0
%=== g
g
emassetotal
calcairedemasse
eagemassiqu
1
/
3
100%