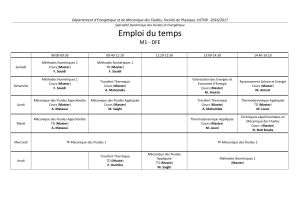
Chapitre 1 : Introduction Fluides complexes

Chapitre 1 : Introduction
Fluides complexes
N.Vandewalle, Professeur Ordinaire, Université de Liège

1. Etats de la matière
• Gaz :
• Liquide :
• Solide :
- pas de cohésion mais collisions
- faible densité
- compressible
- cohésion modérée, phase condensée
- densité élevée
- coule
- cohésion élevée
- densité élevée
- déformations
U= 0
1 kg/m3
pV =NkBT
1000 kg/m3
1000 kg/m3
v2/2 = p0
k2/2 = E
fluides
U < 1 eV
U > 1 eV

2. Fluides complexes (exemples)
• Définition : matière qui s’écoule selon des lois qui diffèrent de celles
provenant de la physique classique.
• Bizarrerie #1 : tas de sable
liquide ou solide ?
- couche roulante / immobile
- avalanches / intermittence
- grains statiques
P.G.De Gennes, Rev. Mod. Phys. 71, S374 (1999)

• Bizarrerie #2 : bulles d’air dans du sirop / shampoing / gel
bulles pointues et connectées !!!
I.L.Kliakhandler, Phys. of Fluids 14, 3375 (2002)

• Bizarrerie #3 : pâte dentifrice
• Bizarrerie #4 : mayonnaise
solide au repos, liquide sous contrainte
un fluide plus visqueux que ses constituants ?
- recette : huile, eau, oeufs
- pourquoi on peut rater la mayonnaise ?
- la pâte coule quand on presse le tube
- la pâte tient sur la brosse à dent
A. Einstein, Ann. Phys. (Leipz.) 19, 371 (1906)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%