Les molécules d`adhérence cellulaire - iPubli

René-Marc Mège


in vitro.


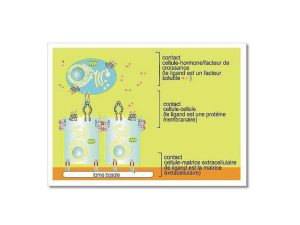
jonctions intermédiaires
jonctions adhé
rentes zonulae adherens
(zonulae adherens)
jonctions serrées
jonctions de type tight
jonctions étan
ches zonulae occludens.
smosomes
jonctions communicantes
jonctions gap
synap
ses chimiques.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%