Fascicule TP -Fichier PDF du Powerpoint

TP de Microbiologie Générale
(MBG)
2010
Université de Nice Sophia-Antipolis, Faculté des Sciences, LSV2

Travaux Pratiques de Microbiologie Générale
MBG, LSV2
2
TRAVAUX PRATIQUES J0 (TP1)
Conseils généraux
*Le port de la blouse est obligatoire
* Apporter une pince fine et un marqueur permanent (pointe fine)
* Travailler dans des conditions d’asepsie près de la source de chaleur et en reproduisant les gestes du
démonstrateur. Par exemple : comment tenir le tube, le bouchon, la pipette ou l'anse de platine utilisée pour
l'ensemencement.
* Repérer les boîtes de chaque binôme à l'aide de vos initiales sur le fond de la boîte.
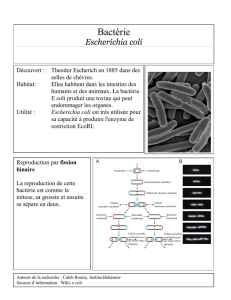
A- Croissance d'Escherichia coli en milieu liquide
a) Etude cinétique de la croissance bactérienne
Il s'agit d'étudier la croissance d'E. coli dans différentes conditions, en milieu liquide non renouvelé. Une
suspension d'E. coli, souche DG1, obtenue par culture dans du LB durant une nuit à 37°C (culture mère) est
fournie à chaque groupe. Trois conditions de culture seront comparées :
tube
: milieu riche LB
tube
: milieu riche LB + NaCl 0,6 M (à préparer)
tube
: milieu minimum M63 (à compléter avec du Glucose, du MgSO
4
et de la thiamine)
Chaque tube contient 4 mL de milieu.
1) A t = 0, inoculer à 2% chaque tube, agiter (vortex) et mesurer la DO
600 nm
2) Placer les tubes sous agitation à 37°C.
3) Toutes les 30 minutes, mesurer la DO
600 nm
(les tubes sont vortexés puis introduits dans le
spectrophotomètre). Attention, le zéro optique de l'appareil sera effectué par les enseignants avec le milieu
correspondant sur les spectrophotomètres.
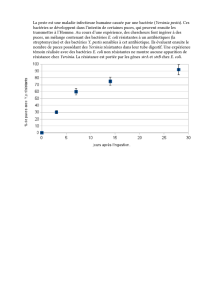
Résultats
Tracer les trois courbes de croissance (DO = f (t)) sur papier semi-logarithmique et compléter ce
graphe.
Déterminer les paramètres de la croissance (g et µ). Conclure.
b) Numération bactérienne
Pour connaître le nombre de bactéries de la culture, on procède à l'étalement sur milieu gélosé LB de la
suspension. On ne peut pas compter plus de quelques centaines de colonies : il faut donc effectuer des dilutions
sérielles.
1) Prélever stérilement 100 µL de la culture mère d'E. coli DG1.

Travaux Pratiques de Microbiologie Générale
MBG, LSV2
3
2) Diluer stérilement de façon sérielle (de 10 en 10) dans un volume final de 1 mL dans le milieu LB stérile
jusqu'à la dilution 10
-7
. (Voir démonstration).
3) Etaler stérilement 100 µL des dilutions 10
-5
, 10
-6
, 10
-7
sur boîte de milieu LB.
4) Mettre les boîtes à incuber à 37°C pendant 24 heures, en position inversée (couvercle en bas) pour
empêcher l'eau de condensation du couvercle de couler sur le milieu gélosé.
Résultats J+1 (lecture au TP2)
Dénombrer les colonies bactériennes et en déduire le titre de votre culture (nombre de bactéries
par ml).
Déterminer le nombre moyen de bactéries par ml pour une DO
600
nm
= 1.
B) Réalisation d'un antibiogramme par la méthode de diffusion en milieu solide : Méthode des disques.
On veut mesurer la zone d'inhibition de la croissance bactérienne autour d'un « comprimé » d'antibiotique
déposé à la surface d'un milieu de culture gélosé. Voir pour la notion de CMI en TP.
1) Diluer stérilement au 1/10 la culture mère d'E. coli DG1 (on prendra la dilution faite pour la numération).
2) Déposer 100 µL sur une boîte de milieu LB.
3) Faire un étalement à l'étaloir (râteau). (Voir démonstration).
4) Application des disques : poser les disques à environ 2 cm de la périphérie de la boîte en appuyant
légèrement pour assurer le contact avec le milieu. Les disques contiennent : 30 µg d’ampicilline (Amp30); 30
µg de rifampicine (Rif30); 100 µg de kanamycine (Kan100); 40 µg de bacitracine (B40), 60 µg de
chloramphénicol (Cm60).
5) Laisser la boîte 30 minutes sur la paillasse puis incuber à 37°C pendant 24 heures
Résultats J+1 (lecture au TP
2
)
Mesurer le diamètre de la zone d'inhibition pour chaque antibiotique et pour chaque
concentration. Conclure pour B. subtilis et E. coli.
C) Ré-isolement de souches à partir d’une population mixte et étalement d’un prélèvement buccal
On réalisera un isolement de souches à partir d'une suspension bactérienne contenant une population mixte de
bactéries dans le but d’obtenir des souches « pures ».
1)- Faire un prélèvement avec l'ensemenceur (fil de platine) et un étalement selon la méthode des stries ou des
cadrans (ci-après) sur une boîte de milieu LB gélosé.
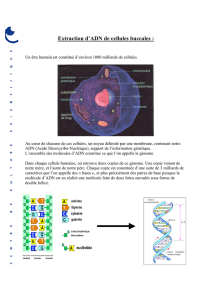
2)- Utiliser un coton hydrophile sur la langue et ensemencer la boîte de milieu gélosé LB (même technique).
3) - Incuber les boîtes à 37°C pendant la nuit.
Résultats à J+1 (TP2)
Après incubation de la boîte, que peut-on conclure ?

Travaux Pratiques de Microbiologie Générale
MBG, LSV2
4
Deux colonies d’aspect différentes seront utilisées pour effectuer une coloration de Gram.
Fig.1 Méthode des stries Fig. 2 Carte du plasmide pBS
D) Préparation du TP2
a) Réplique sur tampon de velours.
- Inoculer les 5 souches bactériennes (fournies par les enseignants) sur une boîte de milieu LB préalablement
orientée et divisée en cinq secteurs. Cette boîte servira de "boîte mère" pour les répliques sur tampon de
velours. Souches DG1, C600, Hfr P4x6, 2000x74M et PA504.
Boîtes pour le TP2
- Les 10 postes couleront soit du milieu LB (300 ml pour 12 boîtes), soit du milieu M63 glucose (250 ml pour
10 boîtes) dépourvu d’histidine (« his »), de proline (« pro ») ou de leucine (« leu »), soit du milieu LB
contenant de l'ampicilline (100 µg/ml). Ces milieux gélosés seront fournis à l'état surfondu (45°C) par les
enseignants.
- Laisser refroidir les boîtes sur les paillasses.
b) Préparation de cellules compétentes d'E. coli par traitement au CaCl
2
But : E. coli est largement utilisée en génie génétique pour le clonage de fragments d’ADN et la production de
protéines hétérologues. Un moyen couramment utilisé pour introduire de l’ADN exogène, le plus souvent sous
forme d’un plasmide circulaire, dans le cytoplasme d’E. coli (et non dans le chromosome !) est d’utiliser la
transformation bactérienne.
On se propose d’introduire un ADN plasmidique , le pBluescript II-KS+ ou pBS (Fig. 2) qui porte un gène
conférant la résistance à l'ampicilline (Amp
R
) chez E. coli. Les cellules ayant reçues ce plasmide ou
transformants seront dénombrées ultérieurement (à définir avec les enseignants).
Principe de la préparation de cellules artificiellement compétentes : Les cellules d'E. coli sont cultivées
jusqu'en phase exponentielle puis concentrées par centrifugation. Ces cellules sont rendues compétentes pour
la transformation par resuspension dans une solution de chlorure de calcium. En présence d'ions calcium, les
cellules sont capables d'ingérer des petites molécules d'ADN, comme un plasmide. Revoir les notions en TP.

Travaux Pratiques de Microbiologie Générale
MBG, LSV2
5
1) Une culture bactérienne d’E. coli à DO
600nm
= 0,4 de volume « Vi » (volume initial) sera fournie au
cours du TP.
2) Centrifuger cette suspension bactérienne 5 min à 3000 rpm à 4°C. Jeter le surnageant stérilement et
délicatement.
3) Resuspendre délicatement le culot bactérien par la moitié du vol. initial de culture (1/2 Vi) par du
CaCl
2
50 mM pré-refroidi à 4°C.
Attention : les cellules doivent toujours rester à 4°C jusqu’à la transformation à J+1
4) Incuber dans la glace pendant 20 min.
5) Centrifuger 5 min à 3000 rpm à 4°C. Jeter le surnageant stérilement et délicatement.
6) Resuspendre délicatement le culot bactérien par le dixième du vol. initial de la culture (1/10 Vi) par du
CaCl2 50 mM (4°C) et stocker au froid jusqu’à utilisation à J+1
TRAVAUX PRATIQUES J+1 (TP2)
A) Transformation plasmidique d'E. coli.
a. Principe de la transformation : Un choc thermique facilite l'entrée de l'ADN plasmidique dans les cellules
d'E. coli rendues artificiellement compétentes. Les cellules traitées sont cultivées dans un milieu liquide non
sélectif afin d'obtenir la synthèse de la protéine qui confère la résistance à l'antibiotique puis elles sont
sélectionnées sur un milieu LB solide additionné d'antibiotique afin d'identifier les cellules qui contiennent
l'ADN plasmidique.
1) - Repérer le tube à hémolyse contenant 10 ng d'ADN plasmidique dilué dans 10 µL d'H
2
O qui est placé sur la
glace (tube à capuchon rouge) et laisser décongeler sur glace les cellules compétentes contenues dans le tube
eppendorf 1,5 mL. Attention : un essai témoin « sans ADN » sera réalisé, en suivant exactement la même
procédure décrite ci-dessus, mais sur un tube à hémolyse ne contenant pas d’ADN au départ
2) - Transférer 100 µl de cellules décongelées dans le tube contenant l'ADN plasmidique (manipulation en
condition stérile). Mélanger doucement (ne pas vortexer). Garder le reste de cellules compétentes présentes
dans le tube eppendorf pour effectuer l’étape (b).
3) - Placer le mélange ADN/cellules 30 minutes sur la glace.
4) - Provoquer un choc thermique en plaçant le tube dans un bain marie à 42°C pendant exactement 45
secondes.
5) - Ajouter stérilement 900 µL de milieu LB stérile. Mettre en culture les bactéries transformées à 37°C sous
agitation pendant 1 heure.
6) - Sortir, après 1 heure d'incubation à 37°C, les cultures de cellules transformées et témoin. Prélever
 6
6
 7
7
 8
8
1
/
8
100%