1er THEME : L`EAU CHAPITRE 1 EAU ET ENVIRONNEMENT TP 2

1er THEME : L’EAU
CHAPITRE 1 EAU ET ENVIRONNEMENT
TP 2 TRACEURS CHIMIQUES – EROSION ET CONCRETION
CORRECTION
NOTIONS ABORDEES :
Isotopie
Dosage colorimétrique
I. LES ARCHIVES DU CLIMAT
1) a) Qu’appelle-t-on des isotopes ?
Des noyaux isotopes sont des noyaux de même numéro atomique Z, mais de nombre de nucléons A différents
b) Que peut-on dire de leurs propriétés chimiques ?
Ils ont les mêmes propriétés chimiques
2) Dans la glace, à quelle molécule appartiennent les atomes d’oxygènes ?
Dans la glace, les atomes d’oxygènes appartiennent aux molécules d’eau
3) Le rapport isotopique 18O/16O mesuré a-t-il la même valeur que lorsque la glace s’est solidifiée ? Pourquoi ?
Le rapport isotopique est le même lorsque la glace s’est solidifiée car ces deux isotopes sont stables et ne réagissent pas
avec d’autres espèces chimiques
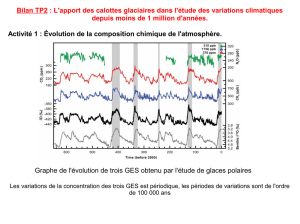
4) A quelle grandeur semble reliée la température de l’air à l’époque de la formation de la glace ?
La température de l’air semble liée à la variation relative δ18O
5) Dans la glace des calottes polaires, le rapport isotopique 18O/16O est légèrement plus faible que dans l’eau de mer,
ce qui prouve un fractionnement isotopique lors du cycle de l’eau. Expliquer
Lors du trajet de l’eau vers les pôles, la vapeur d’eau est appauvrie en 18O. Le rapport 18O/16O dans les précipitations
formées à partir de cette vapeur diminue donc quand on se rapproche des pôles, d’où le terme de fractionnement isotopique
6) Comment évolue la variation δ18O dans la glace polaire fraîchement gelée :
a. Lorsque la température locale diminue ?
Lorsque la température locale diminue, les précipitations à une latitude donnée sont appauvries en 18O. La neige est appauvrie
en 18O, le rapport 18O/16O diminue, donc la variation δ18O dans la glace polaire diminue
b. Lorsque la température locale augmente ?
Lorsque la température locale augmente, la neige est moins appauvrie en 18O, le rapport 18O/16O augmente, donc la variation
δ18O de la glace polaire augmente
7) Comment peut-on montrer que la valeur de δ18O est liée à la valeur de la température en un lieu donné ?
Pour montrer que la valeur de δ18O est liée à la valeur de la température en un lieu donné, on mesure le δ18O dans les
précipitatiosn en un lieu donné en fonction de la température
8) Représenter graphiquement l’évolution de la valeur de δ18O relevée à Halley Bay en fonction de la moyenne annuelle
de la température (AVEC LATIS PRO)
9) Quel est le type de courbe obtenue ? Déterminer son équation
On obtient une droite, fonction affine d’équation T = 0,44T – 13,8
10) En déduire l’effet sur la température d’une augmentation de δ18O de 1,0.10-3.
Une augmentation de δ18O de 1,0.10-3 correspond à une élévation de température de 1/44 = 2,3°C
11) Pourquoi l’équation obtenue est-elle spécifique à Halley Bay ?
Car δ18O dépend aussi de la latitude
12) En quoi les glaces constituent-elles des archives du climat ?
Les glaces, comme les sédiments, constituent des archives du climat, car ils contiennent des traceurs témoins du climat à
l’époque de leur formation
13) On qualifie parfois les glaces de thermomètre isotopique. Expliquer cette expression
La composition isotopique en oxygène des glaces et sédiments est directement liée à la température locale au momant de
leur formation. Mesurer le rapport isotopique 18O/16O permet de déterminer les températures du passé

II. LA DURETE D’UNE EAU
MANUEL P 16-17
1) a) Ecrire les équations de formation de l’ion Y4-(aq) à partir de H4Y(aq)
H4Y(aq) <-> H3Y-(aq) + H+(aq)
H3Y-(aq) <-> H2Y2-(aq) + H+(aq)
H2Y2- (aq) <-> HY3- (aq) + H+(aq)
HY3- (aq) <-> Y4-(aq) + H+(aq)
b) Justifier la dénomination de tétra-acide pour l’EDTA
On peut le qualifier de tétra-acide, car il peut libérer 4 ions H+ (tétra = 4)
2) a) tracer le diagramme de prédominance de l’EDTA
b) Quelles sont les formes prédominantes de l’EDTA à pH = 10
A pH = 10, les espèces prédominantes sont HY3- et Y4-.
c) Pourquoi travailler en milieu tamponné ?
On travaille en milieu tamponné car on ajoute de l’acide (EDTA) qui pourrait faire baisser le pH. Or, il faut que le pH reste
aux alentours de 10, pour observer la réaction entre les ions calcium et magnésium avec l’ion Y4-. En effet, à un pH inférieur,
ce n’est plus la forme prédominante de l’EDTA
3) Quel changement de couleur permet de repérer l’équivalence ? Pourquoi ?
Avant l’équivalence, le NET réagit avec les ions Mg2+ pour former un complexe rose, car les ions magnésium sont en excès
Après l’équivalence, il n’y a plus d’ions magnésium en solution : le NET conserve sa couleur bleue
L’équivalence est donc repérée par le passage de la couleur rose au bleu
4) Faire un schéma légendé du montage
5) Noter le volume équivalent Veq
Pour 10 mL d’eau de contrex, on mesure Veq ≈ 14,5 mL
6) a) Etablir la relation entre C1, concentration molaire totale en ions ca2+ et Mg2+, V1, Veq et C2.
A l’équivalence, la quantité de matière d’EDTA introduite est égale aux quantités de matières de calcium et de magnésium,
d’après les équations de dosage : C1V1 = C2Veq
b) calculer la concentration molaire C1 de l’eau minérale utilisée
C1 =
= 1,45.10-2 mol/L
c) déterminer le titre hydrométrique TH de cette eau
THexp = C1 x 104 = 145°TH
7) Comment peut-on qualifier l’eau minérale dosée ?
TH > 25°TH => Cette esu est très dure
8) a) A partir de l’étiquette de l’eau minérale dosée, déterminer son titre hydrométrique
Concentration molaire en calcium et en magnésium : [Ca2+] = t(Ca)/M(Ca) = 0,486/40 = 1,215.10-2mol/L
[Mg2+] = t(Mg)/M(Mg) = 0,084/24 = 3,5.10-3 mol/L
Ctotale = [Ca2+] + [Mg2+] = 1,565.10-2 mol/L
TH = 104 x Ctotale = 156°TH
b) Comparer ce résultat à celui obtenu expérimentalement
ΔTH =
x 100 = 7%
Les résultats sont proches. Les erreurs peuvent être dus aux erreurs de manipulations (prélèvement, lecture…)
9) Quels sont les cations impliqués dans la formation des concrétions présentes dans les grottes ?
Les cations impliqués dans la formation des concrétions sont les ions calcium et magnésium
10) Quel lien peut-on faire entre la dureté d’une eau et sa capacité à former des concrétions ? En déduire l’intérêt de
déterminer la dureté d’une eau
Plus une eau est dure, plus elle contient d’ions calcium et magnésium, et plus elle pourra former des concrétions. Déterminer
la dureté d’une eau permet donc d’évaluer sa capacité à former des concrétions
1
/
2
100%