La poliomyélite - World Health Organization

Les bases immunologiques de la vaccination
6
La poliomyélite
Programme élargi
de vaccination
Organisation mondiale de la santé
Genève, 1993
WHO/EPI/GEN/93.16
Distribution: Générale
Original: Anglais

Les bases immunologiques de la vaccination
Module 1 : Immunologie générale
Module 2 : Diphtérie
Module 3 : Tétanos
Module 4 : Coqueluche
Module 5 : Tuberculose
Module 6 : Poliomyélite
Module 7 : Rougeole
Module 8 : Fièvre jaune
Le Programme élargi de vaccination tient à remercier ceux dont l’aide a permis la réalisation de ces modules:
Le Programme des Nations Unies pour le développement (PNUD)
La Fondation Rockefeller
Le Gouvernement suédois

Les bases immunologiques de la vaccination
6
La poliomyélite
Dr Susan Robertson
Docteur en médecine
Programme élargi de vaccination
Programme élargi
de vaccination
Organisation mondiale de la santé
Genève, 1993
WHO/EPI/GEN/93.16
Distribution: Générale
Original: Anglais

ii Les bases immunologiques de la vaccination / Module 6: La poliomyélite
© Organisation mondiale de la santé 1993
Ce document n'est pas une publication officielle
de l'Organisation mondiale de la santé (OMS), qui
en possède néanmoins tous les droits. Ce document
peut toutefois être utilisé, résumé, reproduit et traduit
librement, en totalité ou en partie, sauf à des fins
commerciales.
Les vues exprimées dans ces documents sont sous
la responsablité de leurs seuls auteurs.
WHO/EPI/GEN/93.16

WHO/EPI/GEN/93.16 Les bases immunologiques de la vaccination / Module 6: La poliomyélite iii
Table des matières
Préface
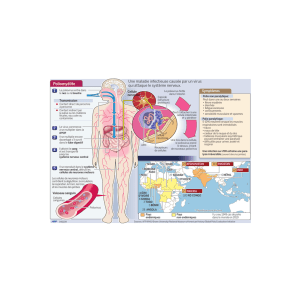
1. Le Virus
2. Nature de l'immunité envers la poliomyélite
2.1 Réponse à l'infection naturelle
2.2 Facteurs de risque
2.2.1
Déficit immunitaire
2.2.2 Injections
2.2.3 Malnutrition
2.2.4
Activité physique
2.2.5
Grossesse
2.2.6
Amygdalectomie
3. Les différentes méthodes de mesure de l'immunité
4
3.1 Anticorps sériques neutralisants
3.1.1 Etalonnage des tests de détection des anticorps neutralisants
3.1.2
Définition de la séroconversion
3.2 Anticorps sécrétoires
3.3 Epreuve expérimentale
3.4 Efficacité protectrice
4
4
5
5
5
6
4. Taux protecteurs d'anticorps antipolio
6
5. Séro-épidémiologie durant la période prévaccinale
7
6. Immunité induite par le vaccin polio oral
8
6.1 Vaccin polio oral (VPO)
8
6.1.l Efficacité du VPO
8
6.1.2 Paralysie associée à la vaccination
9
6.2 Anticorps sériques
9
6.2.1 Persistance des anticorps sériques
9
6.2.2 Séro-épidémiologie après l'emploi du VPO à long terme
11
v
1
1
1
3
3
3
3
4
4
4
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%