Chap 2 : La conduction électrique

Chap 2 : La conduction électrique
I. Tous les solides conduisent-ils le courant électrique ?
Tous les métaux conduisent le courant électrique. Certains métaux le conduisent cependant
plus que d’autres. Plus la résistance d’un matériau est faible, mieux il conduit le courant.
Le verre et les matières plastiques ne conduisent pas le courant électrique.
Etude du document « La découverte de l’électron » p28 sans les questions
Etude du document « Le sens du courant électrique » p29 avec questions 1 et 2
La conduction du courant électrique dans les métaux est due à un déplacement d’électrons
dans le sens opposé au sens conventionnel du courant.
II. Le courant électrique dans les solutions (durée : 1h)
A. Toutes les solutions conduisent-elles le courant électrique ?
Seules les solutions contenant des ions conduisent le courant électrique. La conduction
électrique dans les solutions est donc assurée par des ions. Les ions sont des particules
chargées.
B. Comment les ions se déplacent-ils dans une solution
conductrice ?
Cf activité 3 p 24.
Les ions sont de deux types :
- Chargés négativement (on les appelle alors des anions) ils sont attirés par la borne +
du générateur.
- Chargés positivement (on les appelle alors des cations) ils sont attirés par la borne – du
générateur.

III. D’où proviennent les électrons et les ions mobiles ?
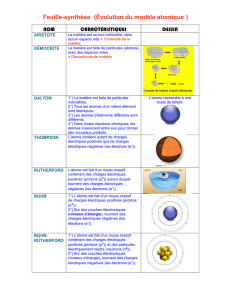
A. Le modèle de l’atome
L’atome est constitué d’un noyau chargé positivement, entouré d’électrons chargés
négativement. Il est électriquement neutre.
La dimension du noyau est de l’ordre de 10-15m et celle de l’atome de 10-10m soit 0,1nm.
L’atome est donc constitué principalement de vide.
Le nombre de charges positives d’un atome est appelé numéro atomique et noté Z. Il permet
de différencier les atomes entre eux. On le trouve dans la classification périodique de
Mendeleïv.
L’atome étant électriquement neutre, le nombre de charges négatives est égal au nombre de
charges positives, soit Z.
Exemple : le sodium Na ; Z= 11 ;11 charges positives dans le noyau ; 11 électrons.
B. Les ions
Un ion simple provient d’un atome ayant gagné ou perdu un ou plusieurs électrons.
Na+ : 1charge positive de plus que les charges négatives.
Cu2+ : 2 charges positives de plus que les charges négatives
Cl- : 1 charge négative de plus que les charges positives
Exemple : sodium Na :Z=11 ; ion sodium Na+ ; 11 charges positives ; 10 charges négatives

1
/
3
100%