AP_files/Séance 2 - Physique nucléaire et des particules

Accompagnement personnalisé TS2 – 2013
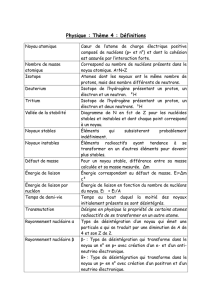
Séance 2 – Physique nucléaire et des particules
Le noyau atomique & les isotopes
Caractéristiques d’un noyau
•Un .............. est formé d’un noyau et d’un nuage élec-
tronique.
•Le .............. d’un atome est formé de nucléons :
– les .............. , de charge électrique positive :
q= +e= 1,602 ×10−19 C
– les .............. , électriquement neutres.
•A est le nombre de nucléons, ou .............. ..............
.............. (la masse du noyau est forcément propor-
tionnelle au nombre de nucléons qu’il contient).
Z est le nombre de protons, ou .............. .............. ,
ou nombre de charges.
N=A-Z est le .............. .............. .............. .
•Un .............. .............. est l’ensemble des atomes de
même numéro atomique Z (ce numéro atomique Z est
le numéro utilisé pour le classement dans le tableau
périodique, car il est égal au nombre d’électrons de
l’atome neutre — ce nombre d’électrons dictant direc-
tement le comportement chimique de l’atome).
•Un .............. est l’ensemble des noyaux de même nu-
méro atomique Z et de même nombre de nucléons A.
Pour représenter l’élément, on utilise une lettre ..............
, suivie éventuellement d’une lettre .............. : H, He, C,
Ca, Co, etc. Cela permet de nommer les 92 éléments
naturels connus, plus tous les autres éléments artificiels
découverts.
Le noyau d’un élément chimique noté X est
symbolisé par :
A
ZX
Exemples : 238
92 U14
6C127
53 I
Les isotopes
L’élément carbone est présent à l’état naturel sous forme
de trois .............. :
12
6C(98,90 %) 13
6C(1,10 %) 14
6C(traces)
Les pourcentages correspondent à l’abondance natu-
relle (pourcentage en masse de chaque isotope, dans un
échantillon naturel quelconque d’atomes), quasi constant
quelque soit l’origine de l’élément. Le carbone 14 est à
l’état de traces uniquement, parce qu’il se désintègre
spontanément (désintégration β−, demi-vie 5 715 ans,
voir plus loin).
Voici quelques données sur des isotopes particuliers. Les
isotopes de l’hydrogène portent aussi le nom de deuté-
rium D et tritium T.
Hydrogène H
Isotope 1
1H2
1H3
1H
Z1 1 1
N = A −Z0 1 2
Abondance 99,985 % 0,015 % traces
Désintégration stable stable β−
Demi-vie 12,32 a
Uranium
Isotope 234
92 U235
92 U238
92 U
Z92 92 92
N = A −Z142 143 146
Abondance 0,005 5 % 0,720 0 % 99,274 5 %
Désintégration α α α
Demi-vie 2,45 ×105a 7,04 ×108a 4,46 ×109a
Des noyaux sont appelés isotopes s’ils ont
le même .............. .............. ..............
.............. , mais des nombres de ..............
.............. différents.
Des isotopes sont donc des versions plus ou moins
« lourdes » du même élément.
1

Stabilité et instabilité des noyaux
Noyaux « radioactifs »
Dans certains cas, les interactions .............. et ..............
sont insuffisantes pour assurer la cohésion d’un noyau.
Celui-ci se transforme spontanément en un autre noyau
en émettant un « rayonnement radioactif ». On dit que
le noyau s’est désintégré.
Un noyau radioactif est un noyau instable,
dont la désintégration est .............. ,
.............. et .............. .
Vue d’ensemble des nucléides connus
Sur 1 500 nucléides connus, il en existe 325 naturels,
dont :
•274 stables : le noyau ne se modifie pas au cours du
temps ;
•51 instables : ils sont radioactifs, le noyau est suscep-
tible de se modifier.
La vallée de stabilité
Lorsque l’on porte l’ensemble des noyaux sur un dia-
gramme N=f(Z), on constate un regroupement appelé
.............. .............. .............. (chaque noyau est repéré
par un carré de couleur).
Noter quelques exemples de noyaux stables ou instables :
.......................................................
•Pour les noyaux stables (en rouge)
– Noyaux légers (A<50) : les noyaux sont groupés au-
tour de la première bissectrice N = Z ;
– Pour les noyaux plus lours : N>Z, la vallée de stabi-
lité est incurvée.
•Pour les noyaux instables : on distingue trois cas :
– En bout de vallée de stabilité (en jaune) : les noyaux
sont trop « lourds », excés de nucléons ;
– Au dessus du domaine de stabilité (en bleu) : excés de
neutron ou défaut de proton ;
– En dessous du domaine de stabilité (en vert) : défaut
de neutron ou excés de proton.
Réactions nucléaires de désintégration
Lois de conservation
Dites aussi lois de Soddy.
Lors d’une réaction nucléaire, il y a conserva-
tion du nombre de nucléons A et du nombre
de charges Z.
Équation générale d’une réaction nucléaire de désinté-
gration :
A
ZX→A1
Z1Y +A2
Z2P
X est le noyau .............. , Y et P sont les noyaux
.............. .
La conservation de la .............. s’écrit : Z=Z1+Z2.
La conservation de la .............. s’écrit : A=A1+A2.
On représente les deux en même temps sous forme d’un
système :
A=A1+A2
Z=Z1+Z2
On va maintenant appliquer ces lois de conservation aux
émissions radioactives découvertes au début du siècle
dernier.
Émission α
Exemple : l’isotope 238 de l’uranium se désintègre spon-
tanément en thorium et .............. , selon la réaction
nucléaire d’équation :
238
92 U→234
90 Th +..............
.............. ..............
Le noyau d’hélium obtenu est aussi appelé particule α,
nom qui date des premières observations de ce type de
radioactivité, alors même que la particule émise n’avait
pas encore été identifiée.
Les particules αsont arrêtées par quelques centimètres
d’air, ou une simple feuille de papier. Elles sont donc
.............. .............. mais cependant très ionisantes : elles
2

sont donc particulièrement dangereuses en cas d’inges-
tion ou d’inhalation du composé radioactif !
Composition du noyau père 238
92 U:
Z = 92
N = A −Z = 238 −92 = 146
Composition du noyau fils 234
90 Th :
Z = 90
N = A −Z = 234 −90 = 144
On constate une perte de .............. protons et de
.............. neutrons. Déplacement correspondant dans la
vallée de stabilité :
N
Z
α
Désintégration β−
Exemple : le cobalt 60, utilisé en radiothérapie pour trai-
ter le cancer (on combat le feu par le feu : le radioélé-
ment permet de détruire sélectivement les cellules cancé-
reuses) :
60
27Co →60
28Ni +..............
.............. ..............
Les lois de conservation de Soddy montrent qu’il faut
mettre zéro en masse pour avoir 60 au total, et un nombre
négatif, -1, en charges pour avoir 27 !
60
27Co →60
28Ni + 0
−1..............
Quelle particule comporte une charge négative d’une
unité sans aucun neutron ? Si on réponds l’.............. à
cette question, un coin du voile se soulève :
60
27Co →60
28Ni + 0
−1e
Cet électron est la particule β−recherchée. Ces parti-
cules sont assez pénétrantes, forcément ionisantes, mais
faciles à arrêter, avec un simple plaque de métal, maté-
riau .............. .
L’équation générale associée s’écrit :
A
ZX→A
Z+1Y + 0
−1e
Reprenons l’exemple précédent. Composition du noyau
père 60
27Co :
Z = 27
N = A −Z = 60 −27 = 33
Composition du noyau fils 60
28Ni :
Z = 28
N = A −Z = 60 −28 = 32
Formellement, la réaction équivaut à l’apparition d’un
.............. , simultanée avec la disparition d’un
.............. :
1
0n→1
1p + 0
−1e
On comprends dès lors que cette radioactivité concerne
les nucléides en .............. de neutron ou en .............. de
proton. Le déplacement correspondant dans la vallée de
stabilité est représenté ci-dessous.
N
Z
β−
3

Désintégration β+
Exemple : le thallium 201, utilisé en scintigraphie myo-
cardique, est un émetteur β+:
201
81 Tℓ→201
80 Hg +..............
.............. ..............
Les lois de conservation de Soddy montrent qu’il faut
mettre zéro en masse pour avoir 201 au total, et +1 en
charges pour avoir 81 :
201
81 Tℓ→201
80 Hg +0
1..............
Quelle particule comporte une charge positive d’une
unité sans aucun neutron ? Simplement, un ..............
.............. .............. ! C’est-à-dire, un positron :
201
81 Tℓ→201
80 Hg +0
1e
Ce positron est la particule β+recherchée. Ces particules
ont une très faible durée de vie, car elles rencontrent ra-
pidement un électron pour se transformer entièrement en
énergie :
0
1e + 0
−1e→γ
L’équation générale de la désintégration β+s’écrit :
A
ZX→A
Z−1Y +0
1e
Reprenons l’exemple. Composition du noyau père 201
81 Tℓ:
Z = 81
N = A −Z = 201 −81 = 120
Composition du noyau fils 201
80 Hg :
Z = 80
N = A −Z = 201 −80 = 120
Formellement, la réaction équivaut à l’apparition d’un
neutron (le 121`eme), simultanée avec la disparition d’un
proton (le 81`eme) :
1
1p→1
0n +0
1e
On comprends dès lors que cette radioactivité concerne
les nucléides en .............. de proton ou en .............. de
neutron. Le déplacement correspondant dans la vallée de
stabilité est représenté ci-dessous.
N
Z
β+
Émission d’un rayonnement γpar désexcitation
Dans les exemples de radioactivités précédentes, le noyau
fils Y est en général formé dans un état excité. Lors de sa
désexcitation, il émet un rayonnement γ(=lettre grecque
« gamma »), de même nature que la lumière, et de très
courte longueur d’onde, inférieure à 1 nm.
Exemple : on reprends le cas du cobalt 60 :
60
27Co →60
28Ni∗+0
−1e
L’astérisque indique un noyau excité. La réaction de
désexcitation est alors :
60
28Ni∗→60
28Ni + γ
L’écriture globale β−plus γest alors :
60
27Co →60
28Ni + 0
−1e + γ
L’équation générale est :
Y∗= Y + γ
Ce rayonnement γest très pénétrant. Une protection,
sous forme de murs de béton et de plomb, est indispen-
sable.
4

Activité d’une source radioactive
Définition de l’activité
L’.............. Ad’une source radioactive est le
nombre moyen de désintégrations par seconde
dans l’échantillon. Elle s’exprime en becque-
rels (symbole Bq), avec 1 Bq = 1 désintégra-
tion par seconde.
Définition de la demi-vie radioactive
La .............. -.............. t1/2d’un échantillon
de noyaux radioactifs est égale à la durée né-
cessaire pour que statistiquement la moitié
des noyaux de l’échantillon présents à la date
tsoient désintégrés à la date t+t1/2.
Au bout du temps égal à la demi-vie t1/2, il ne reste
qu’un noyau radioactif sur deux, et qu’un sur quatre au
bout d’un temps égal à deux fois la demi-vie 2t1/2, etc.
Il faut une durée .............. pour que tous les
noyaux soient statistiquement désintégrés.
La demi-vie radioactive est caractéristique de chaque
noyau radioactif. En particulier lorsque t1/2est de l’ordre
de l’âge du Système Solaire, comme pour l’Uranium, tous
les noyaux instables n’ont pas eut le temps de dispa-
raître !
Facteurs dont dépend l’activité
L’activité Adépend à la fois de la demi-vie de la source
et du nombre de noyaux radioactifs N:
A=ln 2
t1/2
N
L’activité Adécroît selon une loi exponentielle. Au bout
du temps égal à la demi-vie t1/2, il ne reste qu’un noyau
radioactif sur deux, et qu’un sur quatre au bout d’un
temps égal à deux fois la demi-vie 2t1/2.
Source Activité (Bq)
1 litre d’eau 10
1 litre de lait 80
1 kg de granit 1 000
1 homme de 70 kg 10 000
50 kg d’engrais phosphaté 100 000
1 scintigraphie thyroïdienne 3,7×107
1 g de plutonium 2×106
Applications
Paramètres influençant les effets biologiques
•Activité de la source ;
•Énergie et nature des particules émises ;
•Distance de la source ;
•Absorption du milieu ;
•Nature des tissus touchés ;
•Âge de la personne.
Importance de l’activité
L’activité Adépend à la fois de la demi-vie de la source
et du nombre de noyaux radioactifs N:
A=ln 2
t1/2
N
Ainsi, les sources les plus dangereuses biologiquement
parlant sont :
•les sources de très faible durée de vie (t1/2petit donc
1/t1/2grand, donc activité .............. ) ;
•les sources contenant un grand nombre d’atomes ra-
dioactifs (Ngrand donc activité .............. ).
Deux possibilités d’action
Par irradiation À distance, sans contact direct avec la
source ;
Par contamination Par absorbtion (voies digestives
ou respiratoires) de produits radioactifs pouvant
se désintégrer dans l’organisme.
Applications « utiles »
Radiothérapie Destruction sélective de cellules cancé-
reuses ;
Imagerie médicale Par exemple, scintigraphie par in-
jection d’un produit radioactif appelé marqueur,
repérable par son rayonnement ;
Stérilisation Par exemple, pour le matériel médical ;
Conservation Par exemple, pour les fruits et légumes,
par destruction des parasites.
5
 6
6
 7
7
1
/
7
100%