TP 14 : Catalyse
publicité

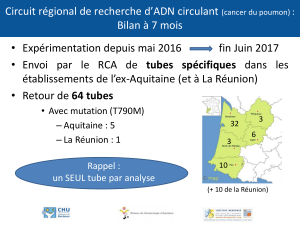
TS Physique chimie Partie : Comprendre Thème : Lois et modèles TP n°14 Suivi de l’évolution d’une synthèse organique – Divers types de catalyse 1ère partie . Suivi de l’évolution d’une synthèse organique par CCM La réaction d’oxydation de l’alcool benzylique par de l’eau de Javel n’est pas instantanée. Suivons l’évolution de cette transformation en analysant le milieu réactionnel par C.C.M. (Chromatographie sur Couche Mince). L’équation de la réaction qui se produit s’écrit : + ClO- → Ligne de front + Cl- + H2O Tache hhh H Ligne de dépôt 1. Expérimentation 1,5cm Préparer une plaque de C.C.M. afin de pouvoir y réaliser 3 dépôts. Dans un erlenmeyer contenant un barreau aimanté, introduire, grâce à une pipette graduée 2,0 mL d’alcool benzylique. Dissoudre l’alcool dans 25 mL Fig. 1. d’éthanoate d’éthyle prélevé à l’éprouvette graduée. Réaliser un premier dépôt avec une pipette Pasteur de ce milieu réactionnel sur la plaque de CCM. Ajouter dans l’erlenmeyer un excès d’eau de Javel, soit 40 mL. Attacher correctement l’erlenmeyer et adapter un réfrigérant à air, puis mettre en route une agitation magnétique vigoureuse et chauffage modéré. Déclencher aussitôt le chronomètre (t =0). Préparer sous la hotte la cuve à chromatographie en y ajoutant une hauteur de 1 cm de dichlorométhane. Mettre le couvercle. Aux instants t = 5 min et t = 20 min, arrêter l’agitation. Laisser décanter réaliser un dépôt de la phase organique (phase supérieure) sur la plaque de CCM. Ne pas oublier de remettre en route l’agitation. N’arrêter le chronomètre qu’à l’issue des 20 min. Quand les trois dépôts ont été réalisés, sécher la plaque au sèche cheveux puis effectuer l’élution. Sortir la plaque quand l’éluant (front du solvant) arrive à environ 1,5 cm du bord supérieur. Révéler la plaque à la lampe à UV, puis repérer les taches qui apparaissent (les cercler et les centrer). 2. Observations et interprétation 2.1. Ecrire l’équation de la réaction avec les formules semi-développées des molécules organiques, puis entourer et nommer les groupes caractéristiques dans ces molécules. 2.2. Combien d’espèces chimiques sont mises en évidence par la CCM aux dates t = 0 ; 5 ; 20 min ? 2.3. Attribuer chaque tache à une espèce chimique organique. 2.4. La réaction est-elle achevée au bout de 20 min ? Justifier. 2.5. Déterminer le rapport frontal (Rf) de chacune des espèces reconnues sur le chromatogramme. INFO ! Le Rf est défini par le rapport : Rf = h/H < 1 et caractérise l’espèce chimique étudiée si la chromatographie est réalisée dans les mêmes conditions. 1/2 2ème partie . Etude de différents types de catalyse. Le peroxyde d’hydrogène (H2O2) , appelé aussi eau oxygénée, est instable. Il se transforme naturellement selon la réaction : 2 H2O2 (aq) → 2 H2O (l) + O2 (g) Il s’agit de la dismutation de l’eau oxygénée : la dismutation est à la fois une oxydation et une réduction . Dans le cas présent, H2O2 s’oxyde en O2 et se réduit en H2O2 : il se dismute. Ecrire les demi-équations correspondantes en repérant au préalable les couples considérés. Cette transformation est lente à 25°C. Etudions l’influence de certaines espèces chimiques sur l’évolution de cette réaction. 1. Expérimentation Préparer 5 tubes à essais remplis à moitié d’eau oxygénée à 10 volumes (soit 0,89 mol.L-1). Dans un 6ème tube, mettre de l’eau distillée (remplir à moitié). Le tube à essais n°1 sera le tube témoin pour la réaction. Ajouter dans le tube à essais : - n°2 : quelques petits morceaux de navet ; - n°3 : une pointe de spatule de dioxyde de manganèse ; - n°4 : un petit morceau de viande ; - n°5 : environ 2 mL de solution de chlorure de fer III : (Fe3+ + 3 Cl-) ; - n°6 : Y ajouter la même quantité de solution de chlorure de fer III que dans le tube n°5 (soit environ 2 mL) : ce tube servira de témoin pour la concentration des ions Fe3+. Au bureau : tube n°7 : eau oxygénée et un fil de platine. 2. Observations et interprétation 2.1. Comparer l’aspect des contenus des tubes en cours de transformation. 2.2. A quoi est due l’effervescence ? 2.3. S’agit-il d’un suivi qualitatif ou quantitatif de la réaction ? 2.4. Les espèces ajoutées dans les tubes à essais sont-elles des réactifs de la réaction étudiée ? 2.5. Que peut-on dire de l’évolution de la concentration des ions Fe3+ responsables de la couleur orangée de la solution du tube à essais n°5, une fois la réaction terminée ? 3. Conclusion 3.1. Les espèces introduites dans les tubes à essais sont des catalyseurs. Quelles sont les caractéristiques des catalyseurs, mises en évidence dans cette activité ? 3.2. On distingue trois types de catalyses : homogènes, hétérogènes et enzymatiques. Définir ces 3 catégories puis classer les catalyseurs utilisés dans cette activité dans les trois catégories évoquées. 3.3. L’eau oxygénée est utilisée pour la désinfection des plaies. Au contact du sang, elle « mousse » (tube n°4). Que peut-on en conclure ? INFO ! Le navet contient une espèce chimique appelée catalase. La catalase est une enzyme. Les enzymes sont des protéines qui accélèrent des réactions chimiques spécifiques. 2/2