Systeme clef de l`immunite innee le complement

UE9-IMMUNOPATHOLOGIE
Pr P.GASQUE
Date : 02/03/2015 Plage horaire : 16h15-18h15
Promo : DFGSM2 2015/2016 Enseignant : Pr GASQUE
Ronéistes :
LAW-KAM Thomas
PARATIAN Rayan
LE SYSTEME CLEF DE L’IMMUNITE INNEE:
LE COMPLEMENT
I-L ‘immunité innée
A. Immunité Innée et Immunité Adaptative
B. Qu'est-ce qu'un pathogène?
1- La reconnaissance sélective (concept 1)
2- Pathogène = microbes + débris dérivés de l'hôte (concept 2)
C. Les mécanismes de reconnaissance
1- Introduction
2- Le rôle du PRR (TLR4)
3- Le rôle du LPS
4- Les différents PRR
D. Un exemple de PRR: Les Toll Like Receptor (TLR)
II- Système de défense contre les virus
III- Système de défense contre les bactéries
A. La phagocytose
B. Le système du complément
1- Introduction, historique, généralités
2- Les 3 voies d'activation

Introduction
L'objectif de ce cours est de comprendre quel est le rôle de l'immunologie. De manière générale, son rôle
essentiel est de tuer les pathogènes.
Le mot «pathogène» devra être pris au sens le plus large possible, ça n'est pas qu'un microbe, ça peut être
une cellule cancéreuse ou une cellule apoptotique.
L'immunologie comprend deux grands volets:
-l'immunité innée (II) immunité naturelle mise en place dès qu'on sera infecté en contact avec un élément
pathogène (phase de minutes à heures)
-l'immunité adaptative (IA) ne peut se faire que si l'immunité innée a été instruite. L'objectif étant de
produire des anticorps, des cellules T, CD4, CD8 qui vont réagir beaucoup plus tardivement.
En d'autres termes, si votre II n'a pas lieu et que vous attendez l'IA, celle-ci ne pourra pas être efficace. Vous
serez déjà décédés de cette infection parce que votre système immunitaire (SI) aura mis trop de temps à
réagir contre l'agent infectieux.
L'II nous protège des éléments pathogènes tout en préservant nos cellules normales. Le système du
complément, pourtant très cytotoxique, va éliminer les pathogènes mais épargner nos propres cellules.
I-L ‘immunité innée
A. Immunité Innée et Immunité Adaptative
-L'II est la première à apparaître, les premières heures
voire les premiers jours suite à une infection.
Elle comprend les phagocytes, les macrophages, les
cytokines pro-inflammatoires (TNFα), les interférons
anti-virales α et β.
(Les interférons γ concernent l'immunité
lymphatique)
-Inéluctablement, l'IA sera beaucoup plus tardive et ne pourra être établit que si l'II a joué son rôle.
Elle comprend les lymphocytes T et les lymphocytes B capables de produire une quantité importante
d'anticorps lorsqu'ils se différencient en plasmocytes.
(Partie infection approfondie par JJH)
Cells and molecules of immunity
Voici une autre représentation de la dichotomie
mais cette fois-ci au niveau des cellules impliqués
dans la fonction des différents SI.
-On abordera essentiellement le rôle des
macrophages, du complément, du neutrophile.
-Les Natural Killer, les basophiles et les
éosinophiles ne seront pas abordés. (Vu avec JJH)
Notez juste que le basophile est impliqué dans
l'asthme et agira contre un pathogène qui est un
allergène. Les éosinophiles sont impliqués dans la
défense anti-parasitaire. Ils vont s’agréger aux
parasites et par un mécanisme de dégranulation,
libérer de nombreuses protéases responsables de la
dégradation du parasite.

-Les cellules de l'II ont des fonctions phagocytaires et de lyse (réaction allergique).
-Dans l'IA, on retrouve les lymphocytes T et B avec une production d'anticorps et de CD8 cytotoxiques.
L'activité cytotoxique est dépendante des CD8 et l'activité de lyse (neutralisation) est dépendante des
anticorps.
Dans le cas du Chikungunya ou du Zika, les Ac vont neutraliser le virus et l’empêcher de pénétrer dans la
cellule cible. Bloquer l'entrée du virus dans la cellule revient à bloquer son action puisque le virus est
dépendant de la cellule hôte pour se répliquer et se multiplier.
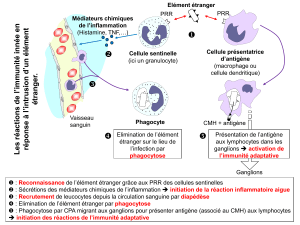
Cette diapo nous rappelle que l'II
est rapide (en heures) et fait
intervenir les macrophages pour
la phagocytose, le système du
complément et les Natural Killer
qui permettent d'éliminer les
bactéries.
Cette première étape permet de
créer l'IA. On parle
d’interconnexion.
B. Qu'est-ce qu'un pathogène?
1. La reconnaissance sélective
-Les cellules reconnaissent l'élément
pathogène et vont le cibler sélectivement.
Cette étape clé est la reconnaissance du non-
soi: le système immunitaire discrimine nos
cellules normales à préserver des cellules
cancéreuses/infectées qui se comportent
comme un pathogène.
-Lyse puis phagocytose.
-Le pathogène exprime un ligand appelé
PAMP (Pathogen Associated Molecular
Pattern). Ex: LPS
-La cellule immunitaire, ici le macrophage, reconnaît sélectivement ce ligand via un récepteur appelé PRR
(Pattern Recognition Receptor).
Ex: Toll-like receptor
Concept numéro 1: Les PRR reconnaissent sélectivement plusieurs ligands.
Sélectivement mais non spécifiquement car il reconnaît non pas un ligand mais plusieurs ligands exprimés
par les pathogènes.
Il faut bien que le système immunitaire reconnaisse une large variété de pathogènes (il existe 50000 virus).
Si la reconnaissance était spécifique, on aurait eu 50 000 récepteurs pour 50 000 virus!
Ce qui fait l'originalité de notre système immunitaire, c'est que seuls quelques PRR suffisent à reconnaître la
plus grande variété et la plus grande complexité de pathogènes.

-Le virus de la rougeole (à gauche)
-Bactérie (au milieu)
-Champignon (à droite)
Seuls quelques PRR sont impliqués dans
la reconnaissance de tous ces éléments
pathogènes, aussi variés et aussi
différents soit-il.
2. Pathogène = microbes + débris dérivés de l'hôte
Concept numéro 2: Les pathogènes ne se réduisent pas seulement aux microbes.
Les cellules cancéreuses et les cellules infectées sont des
pathogènes également et doivent être éliminées par le système
immunitaires.
Cette image montre une infection bactérienne pulmonaire qui a
entraîné une forte nécrose chez un patient décédé:
-en rouge: des bactéries
-en blanc: débris cellR/corps apoptotique/ vésicules/ BLEBs
Ces débris cellulaires comportent des substances toxiques et se comportent donc comme des pathogènes, au
même titre que les bactéries présentes. Ils doivent donc être éliminés.
Si l'organisme a une déficience dans l'élimination et la reconnaissance de ces débris cellulaires, cela peut
aboutir à des maladies auto-immunes:
-débris cellulaires riches en ADN dans le lupus
-myéline dans la sclérose en plaque
Dans le cerveau, l'accumulation de myéline doit être éliminée parce qu'elle fait partie des débris cellulaires.
Si elle n'est pas éliminée, des Ac ou lymphocytes T vont être auto-réactifs contre la myéline donnant la
Maladie de la sclérose en plaque.
Role of host-derived cofactors in
pathological mechanisms (hence a
pathogen)
Cette image montre une infection par un
aspergillus chez un patient décédé qui a été
atteint du VIH et fortement
immunodéficient avec un taux CD4 faible.
La flèche du haut représente l'infection par
un aspergillus.

En plus de cette infection par l'aspergillus dans le cerveau, il a eu une accumulation de neutrophiles (en
noire). Ces neutrophiles qui sont censés venir éliminer l'aspergillus, meurent par apoptose et libèrent une
grande quantité de substances toxiques.
Ce patient a donc doublement succombé:
-par l'infection à l'aspergillus
-par la toxicité des débris cellulaires (neutrophiles apoptotiques)
Les PRR vont reconnaître ces débris cellulaires par le motif DAMPs (Damage/Danger Associated Molecular
Patterns) ou Alarmins.
Innate immune response in adversity
-L'aspergillus (vu précédemment)
-Dans l'ischémie cérébrale (stroke), il y a une très forte destruction du tissu cérébral. Les neurones meurent
par apoptose (noyau en brun, technique Tunnel). Le SI doit reconnaître ces cellules apoptotiques et les
éliminer.
-Dans le cas du cancer du cerveau, le SI peut reconnaître et éliminer les cellules cancéreuses. Le
glioblastome multiforme (GBM) est le cancer du cerveau le plus dangereux. A ce stade (grade IV), l'exérèse
est nécessaire. La survie est possible que si l'exérèse est parfaitement réalisée.
A retenir: Le SI ne reconnaît pas uniquement que des microbes mais également des débris cellulaires dont la
cellule cancéreuse.
C. Les mécanismes de reconnaissance
1- Introduction
How do your cells define "self" versus "danger-sef"
and "non-self"?
(In the absence of acquired knowlegde!!!)
Entre quelque chose du soi et quelque chose du non soi,
en passant par tous les scénarios possibles (plaques
amyloïdes, protéines prions ou bactéries), la tâche du SI
est extrêmement difficile puisqu’il devra d’un côté
préserver et de l’autre reconnaître et s’engager dans
l’élimination de ce pathogène.
Le tout sans aucune connaissance de ce qui est
pathogène et de ce qui ne l’est pas.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%