Bioénergétique

Bioénergétique
Respiration cellulaire
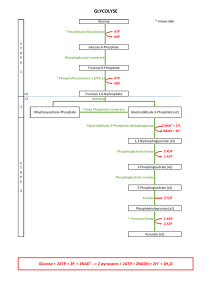
Les cellules obtiennent leur énergie en oxydant le glucose en gaz carbonique et en
eau en condition aérobie, c’est à dire en présence d’oxygène. Dans ces conditions le
pyruvate formé dans la voie de la glycolyse n’est pas forcément transformé en lactate ou
en éthanol par des réactions de fermentation comme dans les conditions anaérobies. Ce
processus cellulaire impliqué dans la consommation d’oxygène et la formation de gaz
carbonique est appelé la respiration cellulaire, par simple analogie avec la respiration
tout court.
On distingue :
- Le glucose mais aussi les AG et certains acides aminés sont oxydés pour
former le groupement acétyle de l’AcétylCoA - Poly –
- Ces résidus acétyles sont oxydés par voie enzymatique en gaz carbonique au
cours d’une série de réaction qu’on appelle le cycle de l’acide citrique.
L’énergie libérée par ces réactions d’oxydations est conservée dans les
transporteurs d’électrons sous leur forme réduite, ces transporteurs sont le
NADH et le FADH2.
- Ces transporteurs réduits sont eux même oxydés pour produire des protons
et des électrons. Ces électrons sont alors transportés le long d’une chaine de
transporteur d’électron qu’on appelle la chaine respiratoire jusqu'à l’oxygène
qui alors réduit en eau (H20). L’énergie libère au cours de ce transfert
d’électron va être conservé sous forme d’ATP grâce a un mécanisme qu’on
appelle la phosphorisation oxydative.
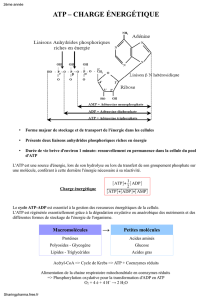
Structure de l’ATP (poly) sructure en anthérocyte lié a un sucre(ribose) et qui constitue
l’adénosine. Dans l’ATP unité de triphosphate est lié a cette adénosine. C’est phosphate
sont appelé le phosphate α( le plus proche),β et γ ( le plus éloigné). en commençant par
le carbone le plus proche du ribose. Cette molécule d’ATP appartient a une famille qu’un
phosphate adénosine AMP, 2phosphate ADP3phosphate ATP. Contient deux
liaisons anhydres phosphoriques qu’on trouve entre les phosphates gamma et alpha, et
beta et alpha. par contre il y a une liaison phospho ester entre phosphate alpha et le
ligand ribose. L’énergie de liaison est plus forte dans le cas des liaisons anydride
phosphorique que dans le cas des liaisons phospho-ester. La raison principale de cette
différence énergique est qu’il excite des répulsion forte entre les charge négatives des
groupement phosphate contigus dans les liaisons anhydrides phosphorique que l’on ne
retrouve pas dans la liaison phospho-ester.
L’hydrolyse de cette molécule : réaction importante, la rupture de la liaison anhydride
acide phosphorique diminue en partie les répulsions électrostatiques présente dans
l’ATP. D’autre par le phosphate inorganique libéré (PI) dans la formule HBO42- est
stabilisé par formation de plusieurs forme que l’on appelle résonante dans les quels
chaque liaisons phosphate-oxygène a le même degrés de double liaison et dans les
quelles l’ion hydrogène n’est pas en permanence associé avec un atome d’oxygène
donné. Ces forme résonnates expliquent la variation d’énergie libre standard ΔG°’ = -
31KJ/mol.
Cette variation d’énergie libre est équivalente pour la réaction d’hydrolyse de la liaison
βγ et αβ

Par contre la variation d’énergie libre standard de l’hydrolyse de la liaison phosphoester
entre le ribose et le phosphate α est beaucoup moins négative puisqu’elle est = à -14
KJ.Mol-1
Ces conditions sont différentes que celles que l’on observe dans la vrai vie. 3 paramètres
cellulaires interviennent pour expliquer cette différence avec les conditions standard.
1e paramètre : liaison standard du magnésium présent dans le cytosol qui peut se
lier à l’ATP et à l’ADP, ce magnésium forme des complexes au niveau des liaison
d’anhydride d’acide phosphorique βγ et αβ.
2e paramètre : Le pH qui modifie les interactions entre groupement phosphate
contiguës
3e paramètre : Concentration relative d’ATP, d’ADP et de phosphate inorganique
qui dans la cellule ne sont pas identique entre elles et surtout qui sont beaucoup plus
faibles que les concentrations arbitrairement définies pour les conditions standard, et
qui sont de 1 molaire. Dans les conditions cellulaires, on peut estimer la variation
d’énergie libre de l’hydrolyse de la liaison βγ de l’ADP comme étant égale à
ΔG= -12Kcal.mol-1. Cette réaction ne se produit que lorsqu’elle est catalysée par un
enzyme, cela s’explique car l’énergie d’activation de l’hydrolyse de l’ATP est élevée.
ATP+ H2O ADP + Pi
Le catalyseur abaisse l’énergie d’activation en liant la molécule. Ne pas confondre
variation d’énergie libre et l’énergie d’activation, cette dernière dépendant du chemin
réactionnel utilisé. L’énergie libre libérée par l’ATP est conséquente, elle est donc
utilisable par des processus endergoniques.
Ex : Pour un travail mécanique, comme contraction du muscle, transport actif d’ions à
travers les membranes biologiques, synthèse de molécules biologiques (macromolécules
informationnelles : ADN ou ARN) Dans de nombreuses réactions de synthèses de
macromolécules biologiques, on observe au niveau de l’ATP une réaction différente de
celle que l’on vient de décrire et qui correspond à l’hydrolyse de la liaison
anhydrique/acide phosphorique entre les phosphates α et β de l’ATP.
ATP + H2O AMP + P-P (pyrophosphate). La variation d’énergie libre de cette réaction
est équivalente à l’hydrolyse de la liaison βγ, elle correspond donc à une variation de
l’énergie libre standard ΔG°’ de -35KJ/mol. L’autre produit une réaction …
pyrophosphatase.
La résultante de ces deux réaction au cours de laquelle les deux liaison anhydrides
phosphorique de l’ATP sont hydrolysées correspond à une variation d’énergie libre
standard qui est la somme des variation d’énergie libre de chacune des réaction qui est =
à -31+ (-31) = -62 KJ/mol.
L’association de ces deux réaction renforce le caractère très exergonique de l’hydrolyse
αβ de l’ATP. Cette réaction rend donc possible par couplage des réactions fortement
endergoniques comme la synthèse de macromolécules biologiques.
Dans de nombreux cas la décomposition de l’ATP ne fait pas intervenir de molécules
d’eau, il ne s’agit donc pas de réaction d’hydrolyse, c’est un autre type de réaction dans
lesquels il y a transfert direct de phosphate depuis l’ATP sur un composé organique qui
va donc pouvoir formé un composé phosphorylé. Il n’y a pas formation de phosphate
inorganique intermédiaire, on appelle ces réactions des réactions de phosphorylation,
elles sont catalysées par des enzymes qu’on appelle des phosphotransferase ou plus
souvent des kinases. La décomposition de l’ATP n’a pas besoin d’eau, elle ne correspond
pas à une hydrolyse. Ex : synthèse de glutamine à partir du glutamate qui est en fait une
réaction en 2 étapes catalysée par la glutamine synthétase ATP dépendante.

Le groupement phosphate est transféré sur une molécule de substrat sur lequel il est
fixé de manière covalente, ceci augmente le contenu en énergie libre du substrat. Dans
un second temps ce groupement phosphate est déplacé en générant du phosphate
inorganique qui est le produit final de la réaction qui est la glutamine. Ce composé reste
à la surface de l’enzyme. L’ATP participe donc à la réaction en fournissant cette énergie
libre.
Il existe d’autre composé phosphorylés qui contiennent des liaisons à haute énergie qui
auront des énergies libres d’hydrolyses importantes.
C’est le cas du phosphoénol pyruvate qui contient une liaison ester phosphate et dont
l’hydrolyse conduit à la formation de pyruvate. Ce pyruvate existe sous 2 formes (formes
tautomère) une des forme est une forme énol car on trouve une fonction alcool au
niveau du carbone. L’autre forme étant une forme céto (fonction cétone) ces deux
formes sont en équilibre et ceci rend le pyruvate plus stable que le phosphoénol
pyruvate. Ceci explique que la variation d’énergie libre standard de cette réaction est
fortement exergonique. Créatine phosphate sert de réserve énergétique en particulier
dans le muscle et dans le cerveau. Cette créatine peut être hydrolysée en libérant un
phosphate inorganique et de la créatine. La créatine est stabilisée par un phénomène de
résonnance. Résonnance dans lesquelles on retrouve sur chaque azote une fraction de
charge positive le nuage électronique est partagé sur les 3 liaisons.
Position médiane de l’ATP a un intérêt, elle permet d’assurer la synthèse d’ATP en la
couplant à la dégradation d’un autre composé phosphorylé ayant une énergie
d’hydrolyse plus négative.
Créatine-P créatine + Pi ΔG°’= -10,3Kcal/mol
AMP + Pi ATP ΔG°’= +7,3Kcal/mol
Il y a des composés dit riches en énergie, pour ceux ayant un ΔG°’ plus négatif que -
25KJ/mol -6Kcal/mol
ATP : -7,3 plus négatif que -6 composé riche en énergie.
Nécessite un apport d’énergie. L’énergie libre libérée par l’hydrolyse de la liaison résulte
que du fait que les produits de la réaction ont un contenu en énergie libre plus faible que
les substrats initiaux
La fonction principale du cycle de l’acide citrique est d’oxydé les groupement acétyles
provenant du pyruvate et qui entre dans le cycle sous la forme d’AcétylCoA, ces
réactions sont cycliques. Cela découvert en 1937 par hanz Krebs.
Cette voie métabolique est cyclique car le groupement acétyle n’est pas oxydé
directement mais après liaison covalente à une molécule d’oxaloacétate qui sera
régénérée à la fin du cycle.
- La première étape conduit à la formation d’acide citrique à partir de
l’acétylCoA et de l’oxaloacétate.
- Au cours du cycle, 2 des 6 carbones du citrate sont oxydés par une série de
réaction qui conduit aussi à la formation d’une nouvelle molécule
d’oxaloacétate, ce qui permet le départ d’un nouveau cycle. Le gaz carbonique
produit au cours de ces réactions diffuse hors de la mitochondrie et quitte la
cellule. L’énergie rendue disponible par l’oxydation du citrate, est conservée
de différentes manières au cours du cycle à une étape qui va du succinil CoA
au succinate. Une liaison phosphate riche en énergie est formée par un
mécanisme que l’on appelle phosphorylation au niveau du substrat et qui est
similaire au mécanisme décrit pour la glycolyse. L’énergie d’oxydation

restante est utilisée à la conversion de molécules transporteuse d’électron
dans leur forme réduite. Il s’agit du NADH et du FADH2 , l’énergie stockée
grâce aux transporteurs d’électrons sur les molécules transporteuses sera
utilisée par des réaction qu’on appelle de phosphorylation oxydative. Ce sont
les seules réactions de cette série qui requiert la présence d’oxygène
moléculaire d’origine atmosphérique (oxygène de l’air). Par contre, les atomes
d’oxygène nécessaire à la formation de gaz carbonique à partir du
groupement acétyle dans le cycle de l’acide citrique sont fournit par l’eau H2O.
Toutes ces réactions se produisent dans la mitochondrie, qui est dans les cellules
eucaryotes le point de convergence de tous les processus cataboliques qui mettent en
jeu les glucides, les lipides ou des protéines. Les mitochondries sont limitées par 2
membranes très spécialisées qui jouent un rôle essentiel dans ses activités, ces
membranes définissent 2 compartiments mitochondriaux distincts : la matrice
mitochondriale interne et un espace intermembranaire.
La membrane externe contient de nombreuses molécules de porine c’est une protéine
de transport qui forme den grands canaux aqueux à travers la bicouche lipidique de la
membrane ces molécules de porine laissent diffuser e part et d’autre de la membrane les
petites molécules d’un poids moléculaire > à 5 KDa. L’espace intermembranaire est
semblable au cytosol en ce qui concerne sa composition en molécules de petite taille. Par
contre la membrane interne est imperméable à un grand nombre de ces molécules. Ce
qui est important pour ce métabolisme.
La matrice mitochondriale interne contient les enzymes qui métabolisent le pyruvate,
mais aussi les acides gras pour produire l’acétylCoA. La matrice contient également des
enzymes du cycle de l’acide citrique. Les molécules qui assurent le transport des
électrons provenant du NADH et du FADH2 qui sont appelé chaine respiratoire sont
localisées dans la membrane interne des mitochondries, ces molécules sont
indispensables à la phosphorylation oxydative qui est le mécanisme qui produit la
majorité de l’ATP dans la cellule.
Formation de l’acétyl CoA
Le pyruvate est oxydé en AcétylCoA et en gaz carbonique après avoir été amené dans la
mitochondrie par un transporteur spécifique. La réaction est catalysée par le complexe
de la pyruvate déshydrogénase. Cette réaction est une décarboxylation oxydative. C’est
une oxydation irréversible par laquelle le groupement carboxyle est retiré du pyruvate
sous forme de gaz carbonique alors que les 2 carbones restants ne sont pas libérés sous
forme d’acide acétique mais sous une forme activée qui pourra ensuit être transférée
sous l’oxaloacétate pour former de l’acide citrique.
Pour que le groupement acétyle puisse être transférer à l’oxaloacétate , il s’agit du
coenzyme d’acétylation ou CoA. Ce coenzyme dérive d’une vitamine du groupe B qui est
l’acide pantothénique, vitamine apporté chez les animaux et chez l’homme par
l’alimentation. L’atome d’hydrogène du groupement thiol peut être substitué par un
radical acétyle. Ce CoA est donc un coenzyme de transport de ce radical acétyle qui le
rend soluble dans le cytosol. En effet la fixation du carboxyle sur la fonction thiol du CoA
conduit à la formation d’une liaison Thio ester riche en énergie. Cette réaction est
catalysée par la pyruvate déshydrogénase qui est un complexe multienzymatique qui
comporte de multiples copies de 3 enzymes différents et de 5 coenzymes. Ces enzymes
E1, E2, et E3

E1 = pyruvate décarboxylase à laquelle est lié un premier coenzyme : pyrophosphate de
thiamine aussi appelé TPP, il s’agit d’un ester phosphorique de la thiamine (vitamine B1)
E2 = dihydrolypoyle transacétylase dont le coenzyme est l’acide lipoïque l’attachement
de cet acide à des chaines latérales de lysine de l’enzyme E2 produit des groupement
lipoine lisyne qui peuvent transporter des groupement acétyle d’un site actif à l’autre
dans le complexe multienzymatique.
E3 = dihydrolypoyle déshydrogénase dont le coenzyme est le FAD (flavine adénine
dinucléotide)
CoA
Le derniere est le NAD+ (nicotinamide adénine dinucléotide)
Dans ce complexe il existe deux protéines régulatrice, une protéine kinase et une
phosphatidile phosphatase en fonction des
Dans les conditions physico chimique , la décarboxylation oxydative du pyruvate est
irréversible et comprend 5 étapes.
Les 3 premières étapes permettent la formation du produit final de la réaction qui est
l’acétylCoA
Les 2 dernières étapes sont des réactions de réoxydation qui permettent au complexe de
revenir à son état initial et donc d’être prêt pour prendre en charge une nouvelle
molécule de pyruvate.
La réoxydation d’une molécule de NADH formée aura lieux grâce à la chaine de
transporteur d’électrons et ceci permettra la formation de 3 molécules d’ATP. C’est par
ce que cette dernière étape nécessite la présence d’oxygène que la décarboxylation est
dite oxydative.
1
/
5
100%