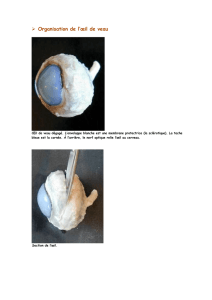
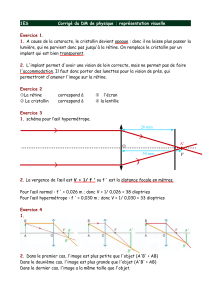
les voies visuelles - Lodel

Œil et Physiologie de la Vision - IV
IV- LES VOIES VISUELLES : RAPPELS ANATOMO-
FONCTIONNELS
Florence Rigaudière
Jean-François Le Gargasson
Eliane Delouvrier
Pour citer ce document
Florence Rigaudière, Jean-François Le Gargasson et Eliane Delouvrier, «IV- LES VOIES
VISUELLES : RAPPELS ANATOMO-FONCTIONNELS», Oeil et physiologie de la vision [En
ligne], IV-Les voies visuelles, mis à jour le 18/06/2013, URL :
http://lodel.irevues.inist.fr/oeiletphysiologiedelavision/index.php?id=209,
doi:10.4267/oeiletphysiologiedelavision.209
Plan
Spécificités du pôle sensoriel
L’œil
Les milieux antérieurs
Le pôle postérieur
Les voies visuelles de conduction
Zone rétrobulbaire : les nerfs optiques
Le canal optique : un passage périlleux
Zone de décussation des voies visuelles
Les tractus optiques
Les corps géniculés latéraux
Les radiations optiques vers les aires visuelles primaires
Les aires visuelles primaires : 80 % de la projection fovéale
Pour information : les aires extrastriées…
Spécificité du pôle moteur
Systèmes oculomoteurs
Coordinations des deux yeux
Retentissement sur l’EOG
Retentissement sur l’ERG flash
En pratique…
Conclusion
1

Œil et Physiologie de la Vision - IV
Texte intégral
Remerciements : Pr Patrick Barbet, Marie-Pierre Beaunoir, Dr S-Yves Cohen, Dr Philippe
Lanthony, Nikola Markov, Dr Th NGuyen, Jean-Philippe Onolfo, François Vital-Durand, Dr
Samir Zeki pour leurs contributions aux illustrations et Dr Philippe Cayrol, Dr Robert
Verdet et Dr Catherine Vignal pour leurs précieuses informations.
Ce chapitre diffère d’une description classique d’anatomie visuelle. Il rappelle quelques
points particuliers de notre système visuel qui peuvent moduler les signaux
électrophysiologiques décrits dans les chapitres suivants : Electro-oculogramme : EOG
(V-2), Electrorétinogrammes : ERG-flash (V-3), ERG multifocal (V-4-A), ERG Pattern (V-
4-B) ou Potentiels évoqués visuels corticaux : PEV flash et damier (V-5).
Spécificités du pôle sensoriel
L’œil
Les milieux antérieurs
Avant d'atteindre la rétine, les rayons lumineux traversent les milieux antérieurs
composés °d’un certain nombre de dioptres liés à la cornée -film lacrymal, dioptre
cornéen antérieur et postérieur- et au cristallin -ensemble des dioptres antérieurs et
postérieurs- et °de milieux transparents avasculaires : l’humeur aqueuse dans la
chambre antérieure de composition proche de celle du plasma et le corps vitré, tissu
conjonctif gélatineux, dans la chambre postérieure (figure IV-1).
Les rayons lumineux sont diaphragmés par l’iris qui règle le diamètre de la pupille
assurant ainsi la régulation et le contrôle de l’éclairement rétinien.
Les dioptres
Ils assurent la réfraction des rayons lumineux et permettent la formation de l’image de
l’objet regardé. Pour que cette image soit perçue nette, elle doit se former au centre de
la surface rétinienne, sur la zone fovéale.
Dioptres sphériques
Les rayons lumineux qui pénètrent dans l’oeil sont limités par la surface pupillaire. La
portion des dioptres alors rencontrée peut être considérée comme sphérique, ce qui
permet l’application de l’approximation paraxiale ; en conséquence, un point objet a pour
image, un point (figure IV-2).
Amétropies sphériques
En considérant un objet à l’infini -c'est-à-dire à 5 mètres-, l’image formée par l’ensemble
des dioptres se forme dans leur plan focal image qui doit être confondu avec le plan
rétinien : c’est la situation de l’emmétropie. L’image peut aussi se former en avant ou en
arrière du plan rétinien ce qui correspond aux amétropies sphériques, respectivement la
myopie et l’hypermétropie (figure IV-3, figure IV-4).
Dioptres astigmates réguliers ou irréguliers
L’ensemble des dioptres mis à contribution pour la réfraction des faisceaux lumineux
incidents, peut ne pas être sphérique. Cependant s’ils sont réguliers et que le dioptre
équivalent présente deux rayons de courbure différents dans deux directions
perpendiculaires, le système est astigmate : c’est la situation de l’astigmatisme régulier.
Tous les points et lignes objet ont une image composée de deux parties dites focales, qui
ne sont pas situées dans le même plan (figure IV-5).
2

Œil et Physiologie de la Vision - IV
L’astigmatisme est le plus souvent dû à la modification de la forme de la cornée qui reste
cependant régulière. Il est classiquement de quelques dioptries et peut être compensé
par des verres. Il est beaucoup plus rarement lié à une modification de forme du cristallin
[el-Hage, Berny, 1973].
La déformation de la cornée peut être importante jusqu'à en devenir irrégulière comme
dans le cas du kératocône qui est à l’origine d’un fort astigmatisme myopique irrégulier
(figure IV-6).
Le kératocône est une maladie cornéenne dégénérative avec atteinte bilatérale et perte de la sphéricité de la
cornée [Grunauer-Kloevekorn, Duncker, 2006]. Il y a protrusion excentrique de la cornée en forme de cône qui
est, le plus souvent, asymétrique entre les deux yeux [Burns et al., 2004]. Elle s’accompagne fréquemment
d’une diminution de l’acuité visuelle avec sensation de brouillard ou d’éblouissement.
La déformation de la cornée peut être irrégulière après un traumatisme cornéen. Le
rétablissement de la régularité de la surface cornéenne est indispensable pour qu’une
image puisse se former ; elle se fait grâce au port d’une lentille de contact rigide (figure
IV-7).
L’iris et la pupille
L'énergie lumineuse d’une stimulation L –luminance exprimée en cd/m2- est délivrée
dans une portion de l'espace large par rapport à la surface pupillaire. Environ 2% de
cette énergie est réfléchie par la cornée, le reste est transmis à travers la pupille pour
l'éclairement rétinien.
La taille de la pupille limite le flux lumineux entrant
La limitation du faisceau lumineux entrant permet l'application des approximations
paraxiales pour les calculs optiques (figure IV-2) et une meilleure mise au point de
l’image sur le plan rétinien par augmentation de la profondeur de champ due à la
diminution des aberrations géométriques.
La taille de la pupille contrôle l’éclairement rétinien
L’éclairement rétinien dépend de la luminance incidente de la stimulation L, du facteur de
transmittance des milieux antérieurs (voir ci-dessous) et de la surface pupillaire S.
Il est défini par la formule empirique suivante : E rét= 0,36 d S L
est sans dimension, S : en cm2, L : en cd/m2. L'éclairement rétinien s'exprime alors en Lux, ce qui sous-
entend que la surface rétinienne éclairée est normale à la direction de la stimulation incidente et évaluée en m2
(!).
La valeur de la transmittance des milieux antérieurs étant difficile à préciser à cause de
ses variations en fonction de la longueur d’onde, on utilise pour l’éclairement rétinien,
une formule simplifiée : E rét= S L, exprimé en troland.
Un troland correspond à un éclairement rétinien de 1 cd/m2 reçu sur toute la surface rétinienne, à travers une
surface pupillaire de 1 mm2
Quelle que soit l'expression utilisée pour l'éclairement rétinien, il varie avec la surface
pupillaire ce qui est fréquent.
La taille de la pupille varie entre deux sujets de même âge
Pour des sujets de même âge, placés depuis un certain temps dans une ambiance
lumineuse donnée, le diamètre pupillaire peut varier entre 3 et 8 mm. Les surfaces
pupillaires correspondantes varient de 7 mm2 à 50 mm2, ce qui correspond à une
variation d'éclairement rétinien de 1 à 7.
3

Œil et Physiologie de la Vision - IV
Cette variation interindividuelle d’éclairement rétinien est une des causes des variations
interindividuelles observées pour les amplitudes des réponses électrorétinographiques
(ERG flash) par exemple.
La taille de la pupille varie en fonction de l’âge
Pour une ambiance lumineuse donnée, le diamètre pupillaire varie en fonction de l'âge du
sujet.
Celui du nouveau-né peut être de petite taille (Ø d’environ 1 mm) [Abramov, Hainline,
1991] ; il est en moyenne de 4 mm de diamètre [Vaughan, Asbury, 1986], il augmente
progressivement avec l'âge, passe par une valeur maximale à l'adolescence puis diminue
avec l’âge (figure IV-8).
La taille de la pupille varie en fonction des caractéristiques des
stimulations
Pour des stimulations structurées, même si leur niveau lumineux moyen est constant, la
modification périodique de la répartition spatiale de leur luminance entraîne des
modifications de tailles pupillaires comme par exemple pour les damiers onset-offset
L'apparition de mires de différentes fréquences spatiales, durant 200 ms -phase onset- suivie de leur disparition
-phase offset- avec leur substitution par un champ lumineux homogène de même niveau lumineux moyen,
entraîne une diminution des diamètres pupillaires, avec des temps de latence allant de 300 à 500 ms [Barbur et
al., 1989] ; ceci revient à dire que, dans cette configuration, si les pupilles sont de tailles naturelles, elles
fluctuent tout au cours de la stimulation.
La taille de la pupille varie en fonction de l’ambiance lumineuse
Le diamètre pupillaire met plusieurs secondes avant d’atteindre sa taille d’équilibre lors
d’un changement d’ambiance lumineuse.
° Variation d’ambiance de longue durée. Pour un passage de la lumière –ambiance
photopique- à une obscurité de longue durée, la taille pupillaire croît progressivement
pour n’atteindre un diamètre stable qu’au bout de 2 minutes environ (figure IV-9).
Réciproquement, lors du passage de l’obscurité à une ambiance photopique de longue
durée, après un bref temps de latence, on observe une contraction pupillaire puis une
relaxation avec de petites oscillations régulières dites « hippus » qui apparaissent à la
fréquence de 2 Hz [Loewenfeld, 1999]. Au bout de 1 à 2 minutes, le diamètre final
moyen est inférieur au diamètre initial comme attendu.
° Variation pas à pas du niveau lumineux de l’ambiance. Certaines procédures
d’enregistrement de l’ERG flash par exemple -qui sortent du protocole clinique classique-
passent de l’obscurité où le sujet a séjourné environ 30 mn, à la lumière, avec une
augmentation pas à pas, pour atteindre des valeurs photopiques élevées. En moyenne, le
diamètre pupillaire diminue progressivement de 8 mm à 2,5 mm avec des valeurs
extrêmes allant de 9 à 1 mm, modifiant l’éclairement rétinien.
Non seulement les cellules rétiniennes qui répondent à une stimulation flash par exemple, varient au cours des
modifications d’ambiances lumineuses, mais également le diamètre pupillaire du sujet. Dans ces cas
spécifiques, les pupilles du sujet sont dilatées par mydriatique pour garantir des pupilles de taille stable au
cours des enregistrements.
° Incrément, décrément lumineux durant environ 200 ms. C’est sensiblement le cas pour
l’enregistrement de l’ERG ON-OFF. S’il y a augmentation -incrément durant 200 ms- ou
diminution –décrément durant 300 ms- du niveau lumineux d’une stimulation ou d’une
ambiance donnée, il se produit d’abord une constriction pupillaire dont la latence est de
l’ordre de 150 à 200 ms pour l’incrément et de l’ordre de 500 ms pour le décrément…
4

Œil et Physiologie de la Vision - IV
° Cas des flashs. Dans une ambiance lumineuse donnée, des flashs répétés provoquent
des constrictions et dilatations successives ou oscillations rapides du diamètre pupillaire
qui se stabilise rapidement autour d’une valeur moyenne fonction du niveau lumineux
moyen du fond [Milton, Longtin, 1990].
C’est le principe des flashs délivrées par les appareils photos juste avant la prise, pour que les pupilles des
sujets se contractent ; ceci évite l’aspect « d’yeux rouges » sur les photos ; les « yeux rouges » ne sont que la
photo du fond d’œil de chaque sujet…
Les oscillations du diamètre pupillaire suivent la fréquence temporelle des flashs. Si elle
est supérieure à 3 Hz, les oscillations pupillaires individuelles fusionnent quasiment
instantanément, le diamètre pupillaire prend alors une valeur moyenne stable qui ne
dépend que de l’intensité du flash [Loewenfeld, 1999].
Cinétique de la dilatation pupillaire par mydriatique
La dilatation pupillaire par mydriatique s’effectue avec un temps de latence de 5 à 10
minutes. Elle n’est complète et stable qu’au bout de 25 à 30 minutes après l’instillation
du topique [Loewenfeld, 1999]. Si elle est mise en oeuvre en vue d’explorations
électrophysiologiques, les enregistrements ne doivent pas débuter avant que leur action
ne soit complète, soit 30 minutes.
Rappel. La dilatation pupillaire par mydriatique s’associe à la paralysie de
l’accommodation et le diamètre pupillaire final varie d’un sujet à l’autre.
En pratique
Au cours d’une exploration fonctionnelle par électrophysiologie, il peut être nécessaire
dans un premier temps, de laisser au sujet la possibilité d’accommoder, puis, dans un
deuxième temps, de procéder à une dilatation pupillaire complète.
Dans ce cas, il faut attendre au moins 25 minutes après instillation du mydriatique pour
débuter l’installation du sujet. Ce temps est relativement long ; il peut être délicat à
supporter pour des patients fatigués ou difficiles.
A notre avis
A moins que le sujet ne présente des pupilles naturelles de très petites tailles -ce qui
entraînerait une diminution importante de l'éclairement rétinien lors de la stimulation- la
dilatation pupillaire systématique ne nous paraît pas nécessaire.
En respectant les précautions d’adaptation rappelées ci-dessus, une pupille de taille
naturelle peut être considérée comme un bon compromis. Dans les conditions de
protocoles standard d’ERG, elle permet que l’éclairement rétinien individuel reste
sensiblement constant et que les réponses enregistrées chez un sujet donné puissent
être comparée d’un examen à l’autre.
Cristallin, accommodation et presbytie
Lorsqu’un objet se rapproche du sujet, le plan sur lequel se forme son image doit rester
confondu avec le plan rétinien. Ceci est possible grâce à une augmentation de puissance
du cristallin, c’est l’accommodation [Krag, Andreassen, 2003].
La capacité accommodative s'émousse avec l'âge ; lorsque l’objet est rapproché, il n’y a
plus coïncidence entre le plan image et le plan rétinien : c'est la presbytie [Strenk et al.,
2005], [Charman, 2008].
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
1
/
54
100%