ECBU - OneDrive

Institut Pasteur d’Algérie
Techniques Microbiologiques
Examen Cytobactériologique des Urines
(E.C.B.U)
F. Djennane
D. Mohammedi
D. Tiouit
D. Touati
K. Rahal Edition 2009

IPA – Techniques Microbiologiques Examen Cytobactériologique des Urines Ed. 2009
2
Déja parus dans la collection : Institut Pasteur d’Algérie
Techniques Microbiologiques:
- M.N Ouar-Korichi-H.Senouci-K.Rahal
Diagnostic bactériologique et sérologique de la brucellose.
ANDS 1998, 1ere édition, 33pages
- R.Bellouni-H.tali-Maamar-K.Rahal
Etude cytobactériologique et biochimique du liquide
céphalorachidien.
ANDS 2000. 52pages
- A.Benslimani-K.Rahal.
Prélèvements génitaux.
ANDS 2001. 128 pages.
- A.S Merad-H.Tali-Maamar-K.Rahal
Diagnostic bactériologique et antibiothérapie des infections
oculaires .
ANDS 2003 . 40 pages.
- M.N Ouar-Korichi-H.Senouci-K.Rahal
Diagnostic bactériologique et sérologique de la brucellose
humaine.
ANDS 2005 2eme édition. 58 pages
- N.Ramdani-Bouguessa-K.Rahal
Diagnostic bactériologique des infections respiratoires
ANDS 2006 . 48 pages.
- M.Azouaou.M.Lazri.S.Mahrane.H.Senouci
Diagnostic de la diphtérie
ANDS 2007 . 94 Pages

IPA – Techniques Microbiologiques Examen Cytobactériologique des Urines Ed. 2009
3
SOMMAIRE
CHAPITRE I................................................................................................................4
INTRODUCTION ..........................................................................................................5
GENERALITES.............................................................................................................6
RAPPEL ANATOMOPHYSIOLOGIQUE..................................................................................7
Rappel anatomique...............................................................................................7
Portes d'entrées..................................................................................................10
Facteurs favorisants l’infection urinaires....................................................................11
Moyens de défense de l’hôte ..................................................................................12
RAPPEL CLINIQUE ..................................................................................................... 14
Cystite.............................................................................................................14
Pyélonéphrite ....................................................................................................14
Prostatite .........................................................................................................14
LE PRELEVEMENT...................................................................................................... 16
Indications de l’E.C.B.U ........................................................................................16
Les conditions du prélèvement................................................................................17
Le matériel....................................................................................................17
Moment du prélèvement....................................................................................18
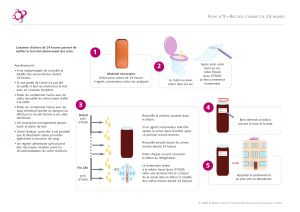
Toilette........................................................................................................18
Recueil des urines ...........................................................................................18
Prélèvement d’urine pour des recherches spécifiques.................................................23
Transport......................................................................................................24
Conservation..................................................................................................24
CHAPITRE II............................................................................................................. 25
Examen cytobactériologique des urines...........................................................................26
Examen macroscopique...............................................................................................26
Détermination du PH urinaire...................................................................................... 26
Examen microscopique .............................................................................................. 27
Examen à l’état frais............................................................................................27
Examen direct après coloration ...............................................................................33
Culture .................................................................................................................. 35
Techniques d’ensemencement ................................................................................35
1- Méthode de référence : Méthode de KASS Modifiée.................................................35
2- Méthode à l’anse calibrée...............................................................................36
3- Lames immergées.........................................................................................37
4- Tests rapides ..............................................................................................38
5- Techniques à base de milieux chromogéniques......................................................40
Choix des milieux de culture...................................................................................44
1- Milieux pour numération bactérienne .................................................................44
2- Milieux d’isolement......................................................................................44
Incubation.........................................................................................................45
Aspect des colonies..............................................................................................45
Identification biochimique des colonies......................................................................48
1- Caractéres biochimiques d’orientation rapide.......................................................48
2- Identification classique ..................................................................................49
3- Identification rapide (API system)......................................................................50
4- Identification des colonies sur milieux chromogènes ...............................................51
5- Identification antigénique...............................................................................52
6- Antibiogramme ...........................................................................................52
Chapitre III.............................................................................................................. 53
Interprétation de l’ECBU ............................................................................................ 54
Interprétation selon la bactériurie et la leucocyturie......................................................... 55
Interprétation selon les germes................................................................................... 60
Interprétation chez le transplanté rénal......................................................................... 62
Chapitre VI ............................................................................................................. 63
Epidémiologie.......................................................................................................... 64
Annexe .................................................................................................................. 70
Références bibliographiques....................................................................................... 74

CHAPITRE I

IPA – Techniques Microbiologiques Examen Cytobactériologique des Urines Ed. 2009
Chapitre I : Généralités 5
INTRODUCTION
L’infection urinaire est une pathologie fréquente, c’est ainsi qu’elle constitue
le principal motif d’exploration microbiologique (l’examen
cytobactériologique des urines représente plus de la moitié des examens
bactériologiques), de même qu’elle est la 2ème pathologie infectieuse
rencontrée en pratique extra hospitalière et nécessite un traitement
antibiotique, d’où des conséquences sur le coût des soins et le développement
des résistances.
Si l’ECBU permet un diagnostic formel de toute infection, sa qualité est
conditionnée par un bon prélèvement, une technique rigoureuse au
laboratoire et l’utilisation de critères d’interprétation reconnus.
La prise en charge correcte d’une infection urinaire nécessite la prise en
compte de 4 éléments décisionnels :
• Clinique : - Sexe du patient
- L’infection : sièges, symptômes, étiologie, évolution,
complexité
• Bactériologique : Bactérie :
- Espèce
- Sensibilité aux antibiotiques
• Epidémiologique : Connaître les résistances bactériennes locales,
régionales ou nationales.
• Pharmacologique : Antibiotiques
- Diffusion
- Demi–vie…
Le diagnostic de la tuberculose sera seulement évoqué pour les raisons
suivantes :
- Symptomatologie et circonstances de découverte souvent différents
- Méthodes de diagnostic bactériologique différentes
- Germe particulier (mycobactéries)
- Atteinte souvent mixte (appareil génital et urinaire)
- Traitements différents.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
1
/
76
100%