Difficultés d`interprétation des bio-marqueurs cardiaques

Introduction
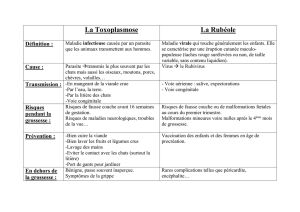
L’évaluation traditionnelle de la fonction cardiaque fait appel à l’électrocardiographie, à la
radiographie et à l’échocardiographie, examens longs, coûteux et pas nécessairement disponibles
dans toutes les structures vétérinaires. Ces dix dernières années, les marqueurs biologiques
cardiaques – ou bio-marqueurs cardiaques – ont pris une place au premier rang dans le diagnostic
et le suivi des cardiopathies chez l’homme, et de nombreux articles ont montré de belles
perspectives pour ces marqueurs chez le chien également.
Pour les cardiologues, il a pu sembler injuste que le cœur, contrairement au foie ou aux
reins, ne puisse pas être évalué par des tests sanguins rapides et largement disponibles. Pendant
des années, les seuls candidats potentiels pour explorer le cœur par voie sanguine ont été la
créatine kinase dans sa fraction MB (CK-MB) ou la myoglobine, sans que ces deux marqueurs ne
donnent entière satisfaction dans leurs résultats ou leur utilisation. La découverte des peptides
natriurétiques a été un grand pas en avant dans l’étude des affections cardiaques chez l’homme,
puis chez l’animal, jusqu’à ce que leur dosage devienne aujourd’hui un examen de routine en
médecine humaine, pour l’établissement du diagnostic ou du pronostic, en Cardiologie, comme en
Urgentologie.
L’intérêt croissant pour ces tests sanguins en médecine vétérinaire repose sur leur large
disponibilité, une méthode peu invasive, un coût faible et le besoin de peu d’équipements
spécialisés puisqu’une prise de sang suffit. Les résultats sont également obtenus rapidement et
peuvent être donnés par un laboratoire d’analyse décentralisé ou un laboratoire d’analyse propre
pour les plus grosses structures.
En médecine vétérinaire, on trouve de nombreuses applications aux bio-marqueurs
cardiaques chez le chien où ils peuvent servir au diagnostic de maladies cardiaques (Maladie
Valvulaire Dégénérative, Dirofilariose, Insuffisance Cardiaque Congestive, Cardiomyopathies
hypertrophiques, Epanchements péricardiques, etc.), comme outil pour faire la distinction entre
des animaux présentant des symptômes respiratoires d’origine cardiaque ou non, ou même lors
d’affections touchant d’autres systèmes (syndrome dilatation-torsion de l’estomac, Piroplasmose)
L’utilisation de ces bio-marqueurs chez le chat n’en est encore qu’à ses tous débuts. Ce
travail se propose de faire le point sur les différents marqueurs disponibles et utiles à l’heure
actuelle en cardiologie vétérinaire féline. Une part importante de ce travail sera également
consacrée aux analyses de ces bio-marqueurs et à la difficulté d’interprétation des résultats des
dosages dans certains cas de figure. Nous développerons par la suite deux enjeux majeurs de
l’utilisation de ces bio-marqueurs cardiaques chez le chat en pratique clinique courante : en
cardiologie, dans le dépistage des cardiopathies et l’optimisation des examens complémentaires
traditionnels ; et en urgentologie, dans la prise en charge d’un chat dyspnéique présentant de
l’œdème ou un épanchement pleural. Enfin, nous terminerons en évoquant des perspectives
concernant l’utilisation de ces bio-marqueurs cardiaques chez le chat, en pratique vétérinaire
courante.

Les marqueurs biologiques disponibles en cardiologie.
Généralités sur les bio-marqueurs
1. Qu’est-ce qu’un bio-marqueur ?
Un marqueur biologique ou bio-marqueur (dérivé de l’anglais bio-marker) est une
« substance dont le dosage permet d’explorer une affection spécifique ». (1)
Un bio-marqueur cardiaque est donc une substance dont le dosage permet d’explorer
spécifiquement une affection cardiaque.
Une définition plus fonctionnelle du bio-marqueur est donnée par le NIH (National Institutes
of Health) : il s’agit d’« une caractéristique que l’on peut mesurer et évaluer objectivement comme
indicateur d’un processus biologique physiologique, pathologique ou comme une réponse
pharmacologique à une thérapeutique mise en place. » (2) (3)
Intérêt des bio-marqueurs et caractéristiques d’un bio-marqueur
idéal
Pour posséder un intérêt clinique, un bio-marqueur cardiaque doit être spécifique de la
cardiopathie considérée. Il doit également être produit en quantité proportionnelle à l’évolution du
processus pathologique qu’il représente de manière à fournir des renseignements sur la présence,
la sévérité et le pronostic de la maladie considérée. Il faut en outre que sa méthode de dosage
(test ELISA, Radio-immunofluorescence, HPLC, etc.) ait été validée analytiquement pour l’espèce
étudiée et que les seuils pathologiques soient significativement différents des seuils de détection.
(4) (5)
Mais pour que ce bio-marqueur puisse être utilisé en pratique clinique courante, il faut que
son dosage soit réalisable « facilement » dans un sens pratique du terme : soit directement sur
place, soit dans un laboratoire d’analyse proche et pour un coût abordable ! (4) (5)
Il existe un réel besoin en tests simples et peu onéreux pour l’identification des chats
cardiopathes asymptomatiques (diagnostic précoce d’insuffisance cardiaque) et pour
l’établissement d’un pronostic pour les animaux atteints de forme sévère d’insuffisance cardiaque.
Considérons par exemple la cardiopathie avec la plus haute prévalence chez les chats
adultes : la cardiomyopathie hypertrophique (CMH). (6) Un test de dépistage idéal de la CMH
devrait posséder une grande sensibilité (c’est-à-dire peu de faux négatifs (FN)) et permettre de
différencier des chats atteints de formes discrètes à sévères, tout en étant suffisamment spécifique
(c’est-à-dire avec peu de faux positifs (FP)) pour être utile. Il devrait également pouvoir aider le
vétérinaire pratiquant l’échocardiographie de dépistage à décider de la présence ou non d’une
CMH lorsque les images obtenues sont équivoques. (5)
En résumé, si un marqueur idéal n’existe pas forcément, pour posséder un intérêt clinique,
un bon bio-marqueur doit donc permettre au moins l’un de ces applications :
- Permettre de détecter des affections en phase sub-clinique ou asymptomatique
- Permettre le diagnostic de syndromes aigus ou chroniques
- Permettre un pronostic du risque
- Permettre d’évaluer la progression d’une affection ou la réponse à une thérapeutique
lors d’un suivi
- Permettre la sélection d’une thérapie plutôt qu’une autre

Les peptides natriurétiques : ANP, BNP, CNP et leurs précurseurs
(NT-proANP & NT-proBNP)
1. Découverte
La fonction endocrine du cœur est maintenant bien établie, et ce depuis qu’il a été
démontré qu’une hormone appelée « peptide atrial natriurétique », synthétisée dans les atria,
sécrétée et transportée par le système cardiovasculaire induit une diurèse et une natriurèse
rénale. Il existe maintenant un très grand nombre d’articles dans la littérature sur la biochimie, la
physiologie et la pathophysiologie de cette famille de peptides ressemblants sur le plan structurel.
(7) (8) (9) Figure 1
Ils sont nommés :
- ANP (Atrial Natriuretic Peptide puis A-type Natriuretic Peptide : peptide atrial
natriurétique), Urodilatine (au niveau rénal)
- BNP (Brain Natriuretic Peptide puis B-type Natriuretic Peptide : peptide ventriculaire
natriurétique),
- CNP (C-type Natriuretic Peptide : peptide natriurétique de type C),
- DNP (Dendroabpsis Natriuretic Peptide), qui n’a pour le moment été identifié que dans
le venin d’un serpent Mamba vert (Dendroapsis angusticeps) (9)
- et VNP (Ventricular Natriuretic Peptide), ce dernier étant probablement seulement
présent chez les poissons. (9)
Figure 1- Les différents membres de la famille des peptides natriurétiques. (9)
Bien que l’ANP et le BNP soient principalement synthétisés au niveau du cœur, d’autre
études ont permis de mettre en évidence la présence de ces peptides dans d’autres tissus :
cerveau, hypophyse, pomons, reins, etc. (7) (9) (10)
Le CNP est sécrété majoritairement par l’endothélium vasculaire et à un moindre degré par
le cerveau, tandis que l’Urodilatine est produite uniquement au niveau du rein. Il n’a pas été
démontré que le DNP et le VNP soient synthétisés dans d’autres espèces. (8)
Structure, biosynthèse & régulation
A l’exception de l’urodilatine qui provient de l’expression du gène codant pour l’ANP au
niveau rénal, ces peptides sont structurellement similaires, mais génétiquement distincts. (7) (8)
ANP – NT-proANP
Le gène codant pour l’ANP félin est un gène de 1072 nucléotides. Sa séquence a été
déterminée par clonage, séquençage par PCR et le peptide en résultant par analyse de type

Nothern-blot. Il est organisé en 3 exons (123, 327 et 12 nucléotides), séparés par deux introns
(101 et 509 nucléotides). Figure 2. Le gène possède des marqueurs typiques des gènes
eucaryotes. (11)
Figure 2- Représentation schématique de l’ADN du gène codant pour l’ANP félin. La taille des séquences est notée. (bp
= paire de bases) (11)
Le préproANP déduit de la séquence nucléotidique est un peptide de 153 aa. Il possède un
peptide signal de 25 aa, qui une fois clivé donne le proANP comprenant une partie amino- (N)
terminale de 98 aa (NT-proANP) et la partie carboxy- (C) terminale de 30 aa. Les deux résidus
Arginine situés en région C-terminale sont probablement clivés pour donner l’ANP active ou ANP-
28. (11) Figure 3
Figure 3- Représentation schématique de la préprohormone ANP (préproANP). Le nombre d’acides aminés (aa) de
chaque séquence est reporté sous chaque segment. RR = résidus arginine de la partie carboxy-terminale. (11)
La séquence peptidique de l’ANP active (ANP-30) est très conservée parmi les espèces
puisqu’elle possède 79% d’homologie avec celle des ovins et 94% avec celle des humains et des
équins. Elle ne diffère de celle des humains, chiens et porcins (ANP-28) que par les deux arginines
en position C-terminale. On note la présence d’un pont disulfure entre 2 cystéines. (11) Figure 4 &
Figure 5
Figure 4- Séquence peptidique de l’ANP humain et canin. (10)
Figure 5- Séquence peptidique de l'ANP félin. (11)
Le peptide signal clivé permet le stockage du proANP dans des granules de sécrétion. La
libération dans le torrent sanguin est médiée principalement par la distension des cardiomyocytes.
(7) (9) (10)
L’ARNm de l’ANP félin n’est détecté que dans les atria des chats adultes. Contrairement à
d’autres espèces, chez lesquelles cet ARNm a été mis en évidence dans les ventricules ou le

septum inter-ventriculaire, c’est le seul site de synthèse active chez le chat adulte sain. (7) (9) (11)
Cet ARNm est cependant exprimé lors du développement fœtal des ventricules, ou lors de
cardiopathie hypertrophique. (7) (9)
BNP – NT-proBNP
Le gène codant pour le BNP félin est un gène de 1500 nucléotides. Sa séquence a été
déterminée par clonage, séquençage par PCR et le peptide en résultant par analyse de type
Northern-blot. Il est organisé en 3 exons (126, 256 et 14 nucléotides), séparés par deux introns
(236 et 574 nucléotides). (8) (12) Figure 6
Le gène possède des marqueurs typiques des gènes eucaryotes. Ces éléments, connus
pour être des éléments régulateurs spécifiques des gènes cardiaques sont la cible finale de divers
stimuli menant à l’augmentation de l’expression du gène codant pour le BNP. (8)
Le gène codant pour le BNP félin a été montré comme proche en distance de celui codant
pour l’ANP félin, sur le bras court du chromosome 1. (8) (12)
Figure 6- Représentation schématique de l’ADN du gène codant pour le BNP félin. La taille des séquences est notée.
(pb = paire de bases). D’après (12)
Le préproBNP déduit de la séquence nucléotidique est un peptide de 132 aa. Il possède un
peptide signal de 26 aa, qui une fois clivé donne le proBNP de 106 aa qui sera lui-même clivé en
une partie N-terminale inactive (NT-proBNP) et une partie C-terminale mature. Le proBNP
présente 3 sites de clivage en forme mature du BNP de 26, 29 ou 35 aa. Il est possible et même
probable au regard de ce qui se passe dans d’autres espèces, que le chat possède plusieurs
formes de BNP mature in vivo. (8) (12) Figure 7
L’ancien dogme selon lequel le proBNP serait clivé de façon équimolaire en BNP actif et
NT-proBNP inactif n’est plus exact et il est aujourd’hui difficile de savoir quelles sont les formes
réellement circulantes des peptides natriurétiques. De plus, une oligomérisation des différents
fragments est permise par des séquences de la région amino-terminale du NT-proBNP, les formes
circulantes comprendraient à la fois du BNP mature et clivé en différents fragments, du NT-
proBNP et des oligomères de ces formes. Enfin, in vivo, une protéolyse intervient à la fois à
l’extrémité carboxy- qu’à l’extrémité amino-terminale des différents peptides. Tous ces éléments
laissent à penser que les formes circulantes du BNP au sens large, sont en réalité un mélange de
l’ensemble de ces peptides plus ou moins longs. (8) (13)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
1
/
61
100%