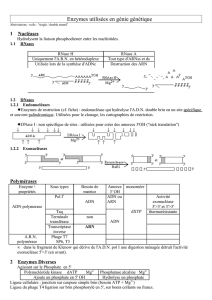
1 A. Définition de la biochimie Etude des atomes : physique Etude

1
A. Définition de la biochimie
Etude des atomes : physique
Etude des molécules : chimie
Etude des cellules : biologie
Etude des organes, des tissus : physiologie
La biochimie est la science qui étudie les réactions
chimiques ayant lieu dans la cellule et dans
l'organisme vivant ainsi que les aspects moléculaires
de la vie cellulaire.
B. Notions de chimie atomique
B.1. Des atomes aux molécules
B.1.1. Définition de l’atome
électrons : négatifs
protons : positifs
Neutrons : neutres
La taille d’un atome est d’environ 1 Ǻ

2
Z = nombre de protons = nombre de charges
A = nombre de nucléons = nombre de masse
X = symbole atomique X
A
Z
N
14
7O
16
8
C
12
6
H
1
1
tableau de Mendeleiev
B.1.2. La règle de l’octet
B.1.3. Les ions
B.1.4. Les molécules
Na+
23
11
Cl-
35
17
He HHC
HH
HH
Valence : nombre de liaisons qu’un atome peut établir.
La taille d’une molécule de glucose est d’environ 10 Ǻ.

3
B.2. Les liaisons chimiques
B.2.1. La liaison covalente
B.2.2. La liaison ionique
B.2.3. La liaison hydrophobe (cf. lipides)
B.2.4. Pont disulfure (cf. protéines)
B.2.5. Liaison hydrogène (cf. acides nucléiques)
C. Les composés biochimiques
C.1. Eléments de chimie minérale
C, H, O, N : 95% de la matière vivante.
+ S, P, Cl, Na, K, Ca, Mg : 99% de la matière.
+ oligo-éléments : Fe, Si, Zn, Al, Cu…
C.1.1. Les cations
Na, K, Ca, Mg, Fe
- régulateurs du maintien des potentiels électriques des cellules : Na+, K+.
- stabilisateurs des structures cellulaires, contraction : Mg++, Ca++.
- régulation des réactions chimiques, catalyseurs : Zn++.
- production de l’énergie nécessaire aux réactions : Fe, Cu…
C.1.2. Les anions
Chlorures, carbonates, phosphates, sulfates.
C.1.3. L’eau
60 à 70% chez l’adulte, 97,5% chez l’embryon de 6 semaines.
Varie selon les tissus. Email dentaire : 0.2%, sang 80%.

4
CCC C C
C.2. Les molécules organiques
· Glucides
· Lipides
· Protides
· Nucléotides et acides nucléiques
C.2.1. Structure générale
C.2.2. Le métabolisme
C.2.2.a. Définition, rôle
Fournir de l’énergie
Fabriquer des réserves
Fabriquer des molécules
Autres
Glucose
Synthèse Dégradation
Amidon

5
C.2.2.b. L’énergie dans la cellule
Adénosine tri-phosphate ou ATP.
Les réactions exergoniques permettent de fabriquer de l’ATP. L’énergie
libérée par la dégradation d’une molécule est stockée dans la liaison d’un
groupement phosphate. ADP + P ÆATP
Les réactions endergoniques consomment de l’énergie, donc de l’ATP.
L’énergie libérée par la cassure d’une liaison entre deux groupements
phosphates est utilisée pour la synthèse d’une nouvelle molécule ou pour la
contraction musculaire par exemple. ATP ÆADP + P
Glucose
ATP ATP
ADP + P ADP + P
Amidon
Réaction Réaction
endergonique exergonique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%





![86 [Quels sont les constituants de l`ADN et de l`ARN? ] ADN](http://s1.studylibfr.com/store/data/007383263_1-9a41736365764fe43d1f9e7462bcdc21-300x300.png)