2008

Cipriano Tp de chimie Organique
Davide Page 44
Synthèse du p-xylène-bis-
pyrimidium bromide (DXP)
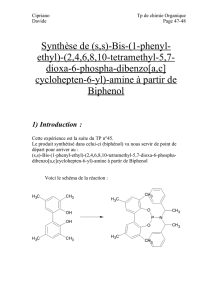
1) Introduction :
Dans Cette expérience, il va s’agir de synthétiser du p-xylène-bis-
pyrimidium bromide (DXP) à partir de pyridine et de α,α’-dibromo-p-
xylène.
Pour la réaction, on utilisera 2 équivalents de pyridine pour un équivalent
de α,α’-dibromo-p-xylène.
Voici le schéma de la réaction :
Br
Br
+
N
2
Acétonitrile
N+
N+
+
Br-
2) Résultats et discussion :
Cette réaction suit le mécanisme d’une substitution nucléophile SN2.
L’atome d’azote de la pyridine va lancer une attaque dorsale sur le
carbone électrophile du α,α’-dibromo-p-xylène éjectant ainsi le groupe
partant qui est le Br-.

Cipriano Tp de chimie Organique
Davide Page 44
Mécanisme :
N
Br
Br
N
SN2
N+
N+
+
2Br-
Analyse des spectres :
Pour cette expérience, une simple analyse RMN a suffi ; le but étant
simplement de s’assurer d’avoir le bon produit et de savoir si celui-ci est
suffisamment pur.
En examinant le spectre on peu observer 2 singulets (sans compter celui
du solvant : D2O), 1 doublet et 2 triplets.
Le premier singulet dont l’intégrale vaut 1, fait un pic à 5.824 ppm et le
second dont l’intégrale vaut également 1 fait un pic à 7.505 ppm.
Le pic du doublet est à 8.871 ppm et son intégrale vaut 1 également.
Les pics des 2 triplets sont à 8.036 et 8.531 ppm. Leurs intégrales valent
respectivement 1 et 0.5.
Si l’on examine la molécule finale, c'est-à-dire le p-xylène-bis-
pyrimidium bromide (DXP), il devient facile de déterminer quels pics
correspondent à quels protons.
N+
5
5
3
3
4
1
2
2
2
2
1
N+
4
3
3
5
5

Cipriano Tp de chimie Organique
Davide Page 44
La première chose à remarquer est que cette molécule est symétrique ;
c’est pourquoi toutes les numérotations de la partie gauche de la
molécule sont les même que celles de la partie droite.
Si l’on considère tout de même la molécule dans son ensemble, on peu
dire que le premier singulet (~5.8 ppm, intégrale = 1) correspond aux 4
seuls protons qui ne sont pas sur un noyau aromatique. (N°1 sur schéma).
Ces protons sont équivalents et n’ont pas de voisins, ce qui explique la
présence d’un singulet.
Le second singulet (~7.5 ppm, intégrale = 1) correspond aux 4 protons
situés sur le noyau aromatique central (N°2 sur schéma).
Si l’on observe ces protons, il apparait qu’ils possèdent tous un voisin
c’est pourquoi ils devraient apparaitre sous forme de doublet. Cependant,
ces protons voisins sont des protons parfaitement équivalent à cause de la
symétrie de la molécule d’où la présence d’un singulet.
Le doublet (~8.9 ppm, intégrale = 1) correspond aux 4 protons qui se
situent sur les carbones voisins des 2 atomes d’azotes dans le noyau
aromatique (N°5 sur schéma).
Ces protons sont facilement reconnaissable car se sont les seuls dans la
molécule à avoir un voisin ordinaire ; d’où la présence d’un doublet.
Le premier triplet (~8.0 ppm, intégrale = 1) correspond aux 4 protons
voisins de la position n°5 sur le schéma.
Ces protons ont 2 voisins non équivalent ce qui explique la présence
d’un triplet.
Le second triplet (~8.5 ppm, intégrale = 0.5) correspond donc aux 2
protons situés sur les extrémités de la molécule (N°4 sur schéma).
Comme précédemment, ces protons ont 2 voisins d’où la présence d’un
triplet.
N
C+
N+
H
H
H
H
H
N
C+N+
H
H
H
H
H
N
C+N+
H
H
H
H
H
Logiquement, la position n°5 devrait être la plus déblindée puisqu’elle se
situe à coté d’un azote électroatracteur. En construisant les formes de
résonnance, il apparait clairement que les positions ortho(n°5) et para(n°

Cipriano Tp de chimie Organique
Davide Page 44
4) seront les plus deblindées (surtout ortho et ensuite para) et que par
conséquent, la position méta(n°3) sera la plus blindé des trois.
On ne peu faire aucun déplacement d’électrons significatifs sur la
position n°2 c’est pourquoi cette dernière sera la plus blindée.
Pour finir, on peu encore observer sur le spectre un dernier singulet à
4.803 ppm. Cela correspond simplement au pic du produit utilisé pour
laver le produit final : l’acétone.
Rendement :
En tenant compte des masses molaires des produits de départ et de fin, et
si le rendement était de 100 %, il aurait fallu obtenir une masse finale
d’environ 9.5 g.
Cependant, le rendement théorique de cette expérience n’est juste pas de
100%.
En effet, après les 20 heures de reflux, nous devrions obtenir 97% et cela
correspond à une masse de produit final d’environ 9.2 g.
Masse produit obtenu : 11.096 g
Masse moléculaire : 244 g/mol
Mole produit obtenu : 0.0455 mol
Rendement : (11.096*100)/9.5 = 116.8%
Ce rendement est supérieur à ce à quoi on pouvait s’attendre.
Cela s’explique simplement par le fait que mon produit final contenait
encore une certaine quantité de solvant.
Le pic à 4.803 sur le spectre confirme cette hypothèse ; il s’agit sans
doute de l’acétone.
3) Conclusion :
Cette expérience s’est très bien déroulée.
Le produit final est sans aucuns doutes le bon au vue des résultats de la
RMN. Le spectre correspond parfaitement aux valeurs du protocole
(moins de 0.1 ppm de différence) et, en dehors du pic du à l’acétone, le
produit est parfaitement pur.

Cipriano Tp de chimie Organique
Davide Page 44
4) Partie expérimentale :
Dans un premier temps, il a fallu mélanger le α,α’-dibromo-p-xylène
(10g) avec l’acétonitrile (800ml) dans un ballon tricol avec réfrigérant et
les mélanger à l’aide d’un barreau magnétique pour dissoudre
complètement le solide.
Ensuite, on ajoute la pyridine (5.1ml) et on chauffe à reflux pendant une
20ène d’heures. Un précipité blanc va se former dans la solution.
Une fois la réaction terminée, on refroidit le ballon à température
ambiante et, une fois que la solution s’est bien décantée, on récupère en
filtrant au Büchner le solide formé.
Pour finir, on lave le solide à l’acétone.
RMN (1H, D2O, 400MHz):
5.82 (s, 4H) ; 7.5 (s, 4H) ; 8.04 (t, 4H) ; 8.53 (t, 2H) ; 8.87 (d, 4H)
Rendement de la réaction est d’environ 97%
5) Références :
•Traité de Chimie Organique, Vollhardt & Schore, 4ème édition.
•Base de données informatique Beilstein
1
/
5
100%