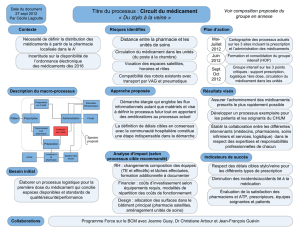
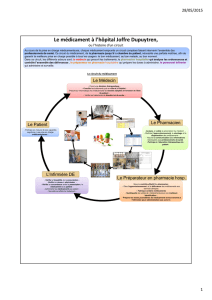
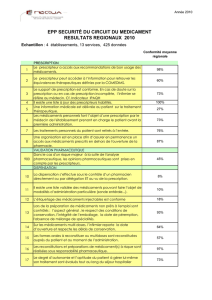
Comment améliorer la dispensation des médicaments

Journées Qualité CIPIQ-S
29-30 janvier 2004
Luxembourg
Le rôle du pharmacien
dans la gestion des risques
Dr Pascal BONNABRY, PD
Pharmacien-chef
Pharmacie
Hôpitaux Universitaires de Genève
Rue Micheli-du-Crest 24
CH-1211 Genève 14
Tél : +41 22 382 39 74
Fax : +41 22 382 39 70
www.hcuge.ch/Pharmacie
La conférence peut-être téléchargée :
www.hcuge.ch/Pharmacie/ens/conferences.htm
1

Vous avez dit risques ?
Bien que les activités de soins aboutissent dans la très grande majorité des cas à un résultat
positif pour le patient, il arrive parfois que la prise en charge soit génératrice de problèmes. De
nombreuses études ont mis en évidence des risques de différentes natures et des activités de
vigilance ont été développées pour les maîtriser (Tab. 1). Depuis le début des années 2000, une
prise de conscience nouvelle existe autour de la problématique des événements indésirables
médicamenteux, et de nombreuses actions sont discutées, en particulier pour prévenir la survenue
des événements évitables, car associés à des erreurs. Le développement d’une meilleure
compréhension de la complexité des processus et des limites de la fiabilité humaine, largement
inspirée par d’autres industries à haut risque comme le nucléaire, l’aéronautique ou l’aérospatiale,
a permis d’élaborer des stratégies de lutte.
Tableau 1 – Risques et vigilances
Risque Type de vigilance
Médicaments
• Effets indésirables Pharmacovigilance
• Processus médicamenteux Iatrovigilance
• Information Infovigilance
Sang Hémovigilance
Dispositifs médicaux Matériovigilance
Infections nosocomiales Infectiovigilance
Le pharmacien est un partenaire privilégié dans la mise en place d’actions visant à sécuriser le
processus médicamenteux, en raison de la vue d’ensemble qu’il détient et de sa capacité de
pouvoir développer de nouvelles activités en réponse aux problèmes de fiabilité. Il est cependant
essentiel que les mesures d’amélioration se décident et se mettent en place avec la participation
active de l’ensemble des corps de métiers concernés, en particulier les médecins et les infirmiers.
Les préoccupations de ces partenaires n’étant pas strictement centrées sur le médicament, mais
plutôt sur le patient, le pharmacien peut jouer un rôle de catalyseur intéressant, en apportant une
vision avant tout axée sur le processus de gestion des agents thérapeutiques.
Quelles erreurs dans le processus médicament ?
L’usage des médicaments en milieu institutionnel est un processus complexe qui peut être
décomposé en deux principaux flux (Fig. 1):
• Le flux de produit, qui dans la cadre de la problématique qui nous intéresse va de sa
fabrication jusqu’à l’administration physique du médicament au patient ;
• Le flux d’information, qui comprend les informations disponibles sur le médicament, ainsi que
la documentation des actes de prescription et d’administration, essentielle pour assurer la
traçabilité.
Des erreurs peuvent survenir à toutes les phases du processus, mais il apparaît aujourd’hui que
les étapes posant le plus de problèmes en terme de fréquence et de gravité sont la prescription et
la phase de préparation/administration, ceci dans des proportions à peu près égales.
En ce qui concerne la prescription, les risques découlent d’une part de problèmes d’inadéquation
pouvant altérer la qualité de la prise en charge thérapeutique du patient et d’autre part
d’imprécisions (lisibilité, exactitude, exhaustivité) favorisant la survenue d’erreurs dans la suite du
processus. Dans le cas de prescriptions rédigées manuellement, il est bien démontré que
l’ensemble des paramètres permettant une interprétation sûre sont peu fréquemment remplis.
2

A
da
p
té de J.-Ph. Re
y
mon
d
,
ICHV
,
200
2
Flux produit Flux information
R & D
Fabrication
Approvision.
Distribution
Préparation
Administration
PK / PD
Elimination
Déchets
Sélection
Logistique
Prescription
Administration
Adaptation
Vigilance
Epidémiologie
Figure 1 – Flux produit / information
Les problèmes de préparation peuvent être la conséquence d’erreurs de calcul des doses, de
sélection des produits, de distribution (mauvais patient, mauvais horaire) ou de manipulation
aseptique dans le cas des médicaments injectables. Des études expérimentales ou d’observation
de la pratique, dans le contexte d’une dispensation globale des médicaments, ont montré des taux
d’erreurs de l’ordre de grandeur de 10-2 (1%) pour la sélection manuelle de produits dans une
armoire à pharmacie et de 10-1 (10%) pour la réalisation de calculs de conversion simples, la
préparation de perfusions (concentration adéquate du principe actif) et les manipulations
aseptiques (taux de contamination des perfusions).
La phase d’administration, quant à elle, génère également des taux d’erreur de l’ordre de grandeur
de 10-1 (10%), avec principalement des problèmes d’horaire, d’omission, de débit et d’identité du
patient.
Les études à disposition démontrent que le processus médicament est source de nombreuses
erreurs dont la conséquence peut parfois être dramatique pour le patient. La complexité de son
organisation traditionnelle impliquant de multiples intervenants et le recours à de nombreuses
opérations dont la sécurité repose sur la fiabilité limitée de l’être humain sont autant de facteurs qui
expliquent cet état de fait. Ces travaux mettent également en évidence les principales étapes à
risque et mécanismes de production des erreurs, permettant ainsi d’imaginer des solutions pour
sécuriser l’emploi des médicaments.
Comment sécuriser le circuit du médicament ?
La stratégie générale d’amélioration de la sécurité du circuit du médicament consiste à réviser de
manière fondamentale les flux de produit et d’information (« re-engineering »), les principaux
objectifs devant être de simplifier, réduire le recours à la mémoire, standardiser les pratiques,
diminuer la ressemblance entre produits, augmenter les barrières de protection et améliorer la
communication. Les principales actions actuellement discutées et dont certaines ont déjà
démontré leur efficacité sont décrites dans la Figure 2.
Du côté du flux produit, de nombreux auteurs préconisent une individualisation de la
distribution des médicaments, avec une préparation des traitements de chaque patient
centralisée à la pharmacie. Si cette approche est intéressante en terme d’erreurs, pour autant que
la préparation soit automatisée, la rigidité qu’elle impose en cas de modification des traitements
est difficile à gérer. La piste qui semble la plus prometteuse à l’heure actuelle est une
individualisation au niveau de l’unité de soins, à l’aide d’automates connectés à une prescription
électronique. Cependant, une évaluation approfondie de ces nouvelles technologies est
indispensable, pour que les éventuels nouveaux risques induits puissent être mis en évidence.
Une première étape d’amélioration doit conduire à optimiser l’organisation de l’approvisionnement
et du stockage et à individualiser le circuit des médicaments à haut risque (ex. chimiothérapies).
3

Flux produit Flux information
R & D
Fabrication
Approvision.
Distribution
Préparation
Administration
PK / PD
Elimination
Déchets
Sélection
Logistique
Prescription
Administration
Adaptation
Vigilance
Epidémiologie
Informatisation
Infovigilance
Conseil
Dose unitaire
CIVAS
Contrôle ultime
Figure 2 – Principales actions visant à sécuriser
le circuit du médicament
La préparation des médicaments injectables comporte d’importants risques et les conséquences
d’une erreur sont généralement très significatives. Afin d’éviter tant les erreurs de dose que la
contamination microbienne, tout en protégeant le personnel soignant de la toxicité de certains
produits (ex. chimiothérapies), les pharmacies hospitalières développent des services de
fabrication de médicaments injectables prêts à l’emploi (CIVAS, Centralised IntraVenous Additive
Service). Ces prestations se sont dans un premier temps concentrées sur les alimentations
parentérales et les chimiothérapies, mais elles s’étendent de plus en plus à d’autres domaines
comme par exemple des produits d’anesthésiologie ou de soins intensifs adultes et pédiatriques.
La sécurité bactériologique est apportée par la propreté de l’environnement de production (habits
stériles, flux laminaires/isolateurs, salles blanches) et la formation des opérateurs de production,
tandis que l’adéquation des doses préparées est notamment garantie par la standardisation de la
fabrication à l’aide de protocoles. Outre l’apport direct sur la qualité des produits, le déplacement
de la fabrication vers la pharmacie est également l’occasion d’effectuer une réflexion fondamentale
sur le déroulement de ces processus, de la prescription à l’administration.
En ce qui concerne le flux d’information, la première étape concerne le choix des médicaments,
qui peut influencer la survenue d’erreurs en raison de confusion pouvant être apportée par des
noms (« sound-alike ») ou des emballages (« look-alike ») qui se ressemblent, des informations
imprécises, incomplètes ou en langue étrangère. Cette problématique doit être systématiquement
prise en compte dans le travail des commissions des médicaments et des interventions doivent
être effectuées auprès de l’industrie pharmaceutique et des autorités d’enregistrement lorsque
l’information disponible peut potentiellement favoriser la survenue d’erreurs (infovigilance).
La phase de prescription fait l’objet de nombreux développements visant à informatiser cet acte.
Le résultat recherché porte sur l’amélioration de la précision, de la lisibilité et de l’exhaustivité, sur
la connexion possible de cet acte avec la suite du processus (robotisation de la distribution), mais
également sur l’amélioration de l’adéquation, par la mise à disposition d’informations pouvant aider
à la décision (directives thérapeutiques, interactions médicamenteuses, allergies, lien avec le
laboratoire, la radiologie, les consultations de spécialistes). Bien que ces outils aient démontré leur
efficacité pour réduire les événements indésirables médicamenteux, le succès de leur implantation
est variable et dépend entre autres des éléments de plus-value apportés au médecin permettant
de justifier le temps supplémentaire accordé à cette tâche.
Le contrôle ultime constitue la dernière étape avant l’administration des médicaments et donc
également la dernière chance de détecter une erreur commise lors de la prescription ou la
préparation. Un simple contrôle visuel des traitements ne permet pas de garantir une performance
adéquate de cette opération, raison pour laquelle certains organismes, dont fait partie en première
ligne la FDA américaine, demandent une identification des doses unitaires à l’aide de codes-
barres. Le déploiement probable de cette technologie dans les années futures devrait permettre
une amélioration significative de la fiabilité de cette étape, tout en améliorant grandement la
traçabilité de la phase d’administration, en la connectant au dossier patient informatisé.
4

5
Pour terminer, le pharmacien peut contribuer à la sécurité du processus médicament par des
activités orientées vers la clinique, que ce soit en collaboration avec les médecins (qualité de la
prescription, polymédication), les infirmiers (stockage, préparation, administration) ou les patients
(compliance, continuité des soins). Les missions principales des pharmaciens assurant ces
activités sont de contribuer à prévenir des situations à risques, en collaborant à la standardisation
des pratiques et à la prise en charge des cas particuliers, de proposer des solutions en impliquant
les autres secteurs de la pharmacie et de participer à la formation du personnel soignant.
Comment progresser ?
Les sources d’erreurs, tout comme les moyens d’action possibles pour réduire leur survenue, sont
nombreux. La maîtrise du processus passera par la mise en place des solutions décrites
précédemment, mais leur implantation nécessitera du temps et parfois une adaptation culturelle
significative. Il s’agit dans un premier temps de créer un climat propice à la gestion des risques,
par un travail interdisciplinaire, une approche systémique des incidents et la mise en place d’outils
d’analyse prospective (analyse de risque) et rétrospective (déclaration d’incidents) de la fiabilité
des processus.
Les flux de produit et d’information doivent être revus, en procédant à une analyse globale du
processus de la prescription à l’administration, en ayant pris soin d’évaluer non seulement les
intérêts potentiels, mais également les nouveaux risques pouvant être induits par les modifications.
La tâche étant d’importance, des priorités doivent être définies en fonction des éléments les plus
critiques dans le contexte local, qui peuvent conduire à débuter, par exemple, par le début du
processus (prescription), par les processus à haut risque (ex. chimiothérapies), par les services à
haut risque (ex. soins intensifs, anesthésiologie, pédiatrie), par les molécules à haut risque (ex.
potassium, héparine, insuline, morphine) ou encore par les voies d’administration les plus critiques
(ex. intrathécal, intraveineux).
Le pharmacien est un partenaire intéressant, car il dispose d’une vue large du processus
médicament au sein de l’institution. Il constitue un partenaire neutre, entre médecin et infirmier, et
il possède une motivation toute naturelle dans cette démarche, celle-ci lui permettant de
développer ou de valoriser certaines de ses activités.
Finalement, force et longueur de temps seront nécessaires à l’amélioration du processus
médicamenteux, mais ce travail devrait permettre de sécuriser la prise en charge des patients, tout
en favorisant un climat de confiance et un travail interdisciplinaire au sein de l’hôpital.
Quelques références bibliographiques
Bates DW, Cullen DJ, Laird N, et al. Incidence of adverse drug events and potential adverse drug events –
implications for prevention. JAMA 1995;274:29-34.
Bates DW, Gawande AA. Improving safety with information technology. N Engl J Med 2003;348:2526-34.
Food and Drug Administration. Barcode label requirements for human drug products. Fed Regist
2001;66:61173.
Institute of medicine. To err is human. Building a safer health system. Washington DC, National academy
press, 1999
Kaushal R, Shojania KG, Bates DW. Effects of computerized physician order entry and clinical decision
support systems on medication safety – a systematic review. Arch Intern Med 2003;163:1409-16.
Leape LL, Cullen DJ, Dempsey Clapp M, et al. Pharmacist participation on physician rounds and adverse
drug events in the intensive care unit. JAMA 1999;281:267-70.
Reason J. Human error : models and management. BMJ 2000;320:768-70.
Schmitt E. Le risque médicamenteux nosocomial, Masson, 1999.
The CIVAS handbook. The centralised intravenous additive services references. Ed. Needle R & Sizer T,
London, Pharmaceutical Press, 1998
PBy-janvier 2004
1
/
5
100%