Effet d`un stress hydrique de début et de fin de cycle chez

Jérémie Marolleau
M1 B2IPME 2013/2014
Effet d’un stress hydrique de début et de fin de cycle chez le pois
INRA UMR Agroécologie, pôle GEAPSI
Maîtres de stage : Marion Prudent et Vanessa Vernoud

Je remercie Marion Prudent ainsi que Vanessa Vernoud qui m’ont permis d’effectuer cette formation dans
les meilleurs conditions possibles et m’ont offert une partie de leur temps et de leur connaissance. Je tiens
aussi à remercier Christophe Salon, le directeur du pôle GEAPSI, qui m’a permis de travailler dans son
bâtiment. Enfin, je tiens à remercier toute l’équipe présente lors de mon stage pour son professionnalisme et
son amicalité.

TABLE DES MATIERES
I) LISTE DES ABREVIATIONS ........................................................................................................................................ 4
II) INTRODUCTION ...................................................................................................................................................... 4
A) CONTEXTE SOCIO-ECONOMIQUE .................................................................................................................................... 4
B) DEVELOPPEMENT DE LA PLANTE DE POIS .......................................................................................................................... 5
C) ACQUISITION D’AZOTE AU SEIN DE LA PLANTE ................................................................................................................... 7
D) LES EFFETS DU STRESS HYDRIQUE CHEZ LE POIS .................................................................................................................. 9
E) CONTEXTE DU STAGE ................................................................................................................................................. 11
III) MATERIELS ET METHODES ....................................................................................................................................11
A) DC, STRESS HYDRIQUE EN DEBUT DE CYCLE .................................................................................................................... 12
B) FC, STRESS HYDRIQUE EN FIN DE CYCLE.......................................................................................................................... 13
IV) RESULTATS ...........................................................................................................................................................14
A) RESULTATS PARTIE DC, STRESS HYDRIQUE EN DEBUT DE CYCLE ........................................................................................... 14
B) RESULTATS PARTIE FC, STRESS HYDRIQUE EN FIN DE CYCLE ................................................................................................ 16
V) INTERPRETATION ..................................................................................................................................................17
A) INTERPRETATION PARTIE DC, STRESS HYDRIQUE EN DEBUT DE CYCLE ................................................................................... 17
B) INTERPRETATION PARTIE FC, STRESS HYDRIQUE EN FIN DE CYCLE ......................................................................................... 18
VI) CONCLUSION ........................................................................................................................................................19
VII) RÉFÉRENCES BIBLIOGRAPHIQUES ........................................................................................................................19

I) Liste des abréviations
- C : Carbone - N : Azote
- WW : Plantes bien arrosées, “Well Watered” - PPHD : Plateforme de Phénotypage à Haut Débit
- WS : Plantes stressées, “Water Stressed” - NS : Non significatif
- DC : Expérience stress hydrique en début de cycle
- FC : Expérience stress hydrique en fin de cycle
II) Introduction
A) Contexte socio-économique
En France, les cultures de légumineuses représentaient 161 000 ha (avec 55 % de haricot, et 24 % de
fèves et féverole) au début des années 1960, principalement cultivées comme source de protéine pour
l'alimentation humaine. Entre 1950 et 1985 la consommation de légumineuses à graines a chuté de 7.3 à 1.4
kg par personne et par an avec l'évolution des régimes alimentaires. La quasi absence de soutien politique et
économique a finalement rendu les surfaces cultivées inférieures à 15 000 ha (moyenne 2003-2007) en
France pour la production destinée à l'alimentation humaine (Cavaillès, 2009).
Chez le pois, malgré trente années de sélection variétale ayant permis une amélioration de son
rendement en graines, le niveau reste bien en dessous de celui des céréales. Nous pouvons aussi noter que
depuis le début des années 2000, une très forte variabilité interannuelle se fait sentir sur les rendements
agricoles. Souvent, la culture de pois disparaît des rotations ou se retrouve déplacée vers de moins bonnes
terres (Voisin et al., 2013). Qui plus est, les rendements ont été beaucoup affectés ces dernières années par le
changement climatique, en particulier par les fortes températures ou encore la fréquence et l’intensité des
stress hydriques (Vadez et al., 2012).
Les légumineuses ont la capacité à fixer l’azote de l’air lors de la symbiose avec des bactéries du sol
du genre Rhizobium. Ceci leur offre un grand potentiel d’insertion dans les systèmes de culture à faible
niveau d’émission de gaz à effet de serre et à bas niveaux d’intrants. De plus, elles sont une source de
protéines végétales possédant des caractères complémentaires à celles des céréales (Voisin et al., 2013).
Dans les systèmes de culture actuels, les légumineuses ont un rôle de culture de diversification, ce qui permet
une réduction des intrants pour l’ensemble de la culture et une rupture des cycles des bio-agresseurs. Les
légumineuses pourraient jouer un rôle majeur dans la transition écologique d’une part -vers des systèmes
plus durables via une réduction de la consommation d’énergie et d’autre part en participant à un régime
alimentaire plus sain. En effet, la réponse de l’agriculture aux besoins des neuf milliards d’individus qui
vivront sur la planète à l’horizon 2050, pourrait bien être une substitution partielle des protéines animales par
des protéines végétales offrant ainsi aux légumineuses un intérêt renouvelé (Dorin et al., 2011).

B) Développement de la plante de pois
1) Le pois, généralitées
Le pois, Pisum sativum, est une
plante grimpante herbacée annuelle, de la
famille des Fabacées (couramment appelé
légumineuses). Le cycle végétatif du pois est
d'environ 140 jours pour les variétés de
printemps, mais pouvant descendre jusqu’à
90 jours pour les variétés ultra-précoces et
monter à 240 jours pour les variétés d'hiver.
Le fruit par la suite se développe en 3 à 4
semaines suivant les espèces (Figure 1).
Le phytomère, initiée par le
méristème caulinaire, forme la tige de pois.
Peu importe son âge et sa position, un
phytomère est constitué :
D’un entre-nœud, c'est-à-dire la fraction de la
tige entre l’insertion du phytomère considéré
et de la feuille du phytomère précédent, et
d’une feuille. Pour les variétés dites
‘’feuillues’’ la feuille se compose de une à
trois paires de folioles et de vrilles ainsi que d’une paire de stipules. Chez les variétés dites ‘’afila’’, des
vrilles remplacent les folioles. Il est intéressant de noter que les stipules ne sont pas des feuilles mais des
organes mixtes folio-caulinaires (possédant une fonction de méristème) (Nougarèdes et Rondet, 1973b).
Cependant, au niveau fonctionnel, on les considère comme faisant partie de la feuille car elles possèdent la
partie principale des surfaces photosynthétiques et transpirantes.
2) Développement racinaire et nodulation
Le système racinaire du pois se compose d’une racine principale et de racines latérales primaires et
secondaires, qui sont produites de manière acropète sur la racine mère. On distingue trois phases lors de sa
mise en place (Mitchell and Russel, 1971) :
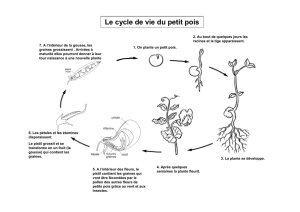
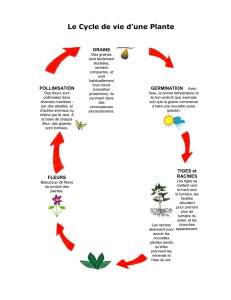
Figure 1: Cycle de vie du pois (Science & Plants for Schools)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%