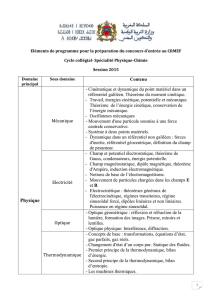
Notions de bases sur les mécanismes réactionnels

N
NN
N
N
NN
N
N
NN
No
oo
o
o
oo
o
o
oo
ot
tt
t
t
tt
t
t
tt
ti
ii
i
i
ii
i
i
ii
io
oo
o
o
oo
o
o
oo
on
nn
n
n
nn
n
n
nn
ns
ss
s
s
ss
s
s
ss
s
d
dd
d
d
dd
d
d
dd
de
ee
e
e
ee
e
e
ee
e
b
bb
b
b
bb
b
b
bb
ba
aa
a
a
aa
a
a
aa
as
ss
s
s
ss
s
s
ss
se
ee
e
e
ee
e
e
ee
es
ss
s
s
ss
s
s
ss
s
s
ss
s
s
ss
s
s
ss
su
uu
u
u
uu
u
u
uu
ur
rr
r
r
rr
r
r
rr
r
l
ll
l
l
ll
l
l
ll
le
ee
e
e
ee
e
e
ee
es
ss
s
s
ss
s
s
ss
s
m
mm
m
m
mm
m
m
mm
mé
éé
é
é
éé
é
é
éé
éc
cc
c
c
cc
c
c
cc
ca
aa
a
a
aa
a
a
aa
an
nn
n
n
nn
n
n
nn
ni
ii
i
i
ii
i
i
ii
is
ss
s
s
ss
s
s
ss
sm
mm
m
m
mm
m
m
mm
me
ee
e
e
ee
e
e
ee
es
ss
s
s
ss
s
s
ss
s
r
rr
r
r
rr
r
r
rr
ré
éé
é
é
éé
é
é
éé
éa
aa
a
a
aa
a
a
aa
ac
cc
c
c
cc
c
c
cc
ct
tt
t
t
tt
t
t
tt
ti
ii
i
i
ii
i
i
ii
io
oo
o
o
oo
o
o
oo
on
nn
n
n
nn
n
n
nn
nn
nn
n
n
nn
n
n
nn
ne
ee
e
e
ee
e
e
ee
el
ll
l
l
ll
l
l
ll
ls
ss
s
s
ss
s
s
ss
s
I
I_
_
É
Ét
tu
ud
de
e
t
th
he
er
rm
mo
od
dy
yn
na
am
mi
iq
qu
ue
e
A
A.
.
E
En
nt
th
ha
al
lp
pi
ie
e
l
li
ib
br
re
e
En thermodynamique, une réaction est dite favorable si la variation d'enthalpie
libre est négative, et défavorable si elle est positive. Sa valeur est donnée par la loi
de Gibbs :
∆G = ∆H - T∆S
ou encore
∆G = - RT x log k
De manière générale, le facteur ∆H est déterminant, c'est-à-dire que l'on va
vers des molécules plus stables ; ∆S est déterminant lorsque l'on crée plus de
désordre, lorsqu'un cycle est brisé par exemple.
B
B.
.
L
Li
im
mi
it
te
es
s
d
de
e
l
la
a
t
th
he
er
rm
mo
od
dy
yn
na
am
mi
iq
qu
ue
e
Cependant la thermodynamique n'indique pas si la réaction s'effectue
effectivement dans les conditions du milieu, notamment elle ne nous indique pas la
vitesse de réaction.
En effet ∆G ne compare que les réactifs et les substrats, mais ne nous dit pas
par quel chemin ils se transforment. Il faut alors observer les données cinétiques.
La cinétique nous informe sur la vitesse d'apparition et de disparition des
réactifs et des produits.
C
C.
.
P
Pr
ri
in
nc
ci
ip
pe
e
d
de
e
m
mi
ic
cr
ro
o-
-r
ré
év
ve
er
rs
si
ib
bi
il
li
it
té
é
La réaction peut théoriquement aller aussi bien dans un sens que dans un
autre. En chimie organique, toutes les réactions sont théoriquement réversibles.
I
II
I_
_
T
Th
hé
éo
or
ri
ie
e
d
de
e
l
l'
'é
ét
ta
at
t
d
de
e
t
tr
ra
an
ns
si
it
ti
io
on
n
G
Réactif
Produit
∆G < 0
Réaction facile ?
Difficile ?
La thermodynamique nous dit que la
réaction est favorable, mais il faut connaître
les conditions cinétiques.

A
A.
.
D
Dé
éf
fi
in
ni
it
ti
io
on
n
L'état de transition est l'état le plus énergétique
par lequel la molécule passe pour se transformer en
produit. On ne peut pas observer un état de transition
car il se transforme spontanément en produit.
Pour atteindre l'état de transition, il faut fournir
de l'énergie. On l'appelle l'énergie d'activation, que
l'on note ∆
∆∆
∆G
≠
≠≠
≠
.
e
ee
e Un état de transition ne correspond pas à un intermédiaire. Un intermédiaire est
un état légèrement stable entre le réactif et le produit et on peut l'observer.
B
B.
.
P
Po
os
st
tu
ul
la
at
t
d
de
e
H
Ha
am
mm
mo
on
nd
d
L'état de transition correspond à une molécule dont la forme ressemble en
partie à la molécule initiale et à la molécule finale. Sa structure est plus proche de
l'état dont l'énergie est la plus proche.
Ainsi lorsque l'état de transition a une énergie proche de l'état intermédiaire, il
suffit de comparer les états intermédiaires ( sous-entendus proches de l'état de
transition ) pour déterminer leur réactivité.
I
II
II
I_
_
C
Co
on
nt
tr
rô
ôl
le
es
s
t
th
he
er
rm
mo
od
dy
yn
na
am
mi
iq
qu
ue
e
e
et
t
c
ci
in
né
ét
ti
iq
qu
ue
e
A
A.
.
D
Dé
éf
fi
in
ni
it
ti
io
on
ns
s
Le contrôle thermodynamique entraîne la réaction de manière à former les
molécules les plus stables ( G le plus petit possible ).
Le contrôle cinétique entraîne la réaction de manière à former la molécule
de la manière la plus facile ( ∆G
≠
le plus petit possible ).
B
B.
.
E
Ex
xe
em
mp
pl
le
e
d
de
e
c
co
on
nt
tr
rô
ôl
le
e
1
1)
)
F
Fo
or
rm
ma
at
ti
io
on
n
d
de
es
s
é
én
no
ol
la
at
te
es
s
d
de
e
c
cé
ét
to
on
ne
e
G
Réactif
Produit
∆G
∆G
≠
État de transition
G
Réactif
Produit
État de transition
Intermédiaire
État de transition

Ainsi on observe sur le diagramme énergétique :
2
2)
)
R
Ré
éa
ac
ct
ti
io
on
n
d
d'
'i
is
so
om
mé
ér
ri
is
sa
at
ti
io
on
n
d
de
es
s
a
al
lc
cè
èn
ne
es
s
à
à
p
pa
ar
rt
ti
ir
r
d
d'
'a
al
lc
cy
yn
ne
es
s
On observe qu'à partir d'un alcyne, on peut former deux isomères différents :
En observant la quantité de produit formé au cours de la réaction on peut déjà
déterminer quel est le produit cinétique et le produit thermodynamique.
On peut expliquer ce comportement d'après le déroulement de la réaction. La
réaction se fait par étape, et le produit cinétique se forme en premier.
OO O
H
H
H
H
Base forte
encombrée Base faible
plus de possibilités
plus accessible
Conditions cinétiques
plus stable
Conditions thermodynamiques
Le produit est moins stable mais ∆G≠ est
plus petit, on obtient le produit cinétique.
Le produit est plus stable, on obtient
le produit thermodynamique.
Ph HCl
Al
2
O
3
Ph
Cl
+
Ph
Cl
Isomère E Isomère Z
Plus stable
t
Plus rapide à former (ici premier à se former )
Produit cinétique
Plus lent à former
Plus stable
Plus nombreux sur le long terme
Produit thermodynamique
Z
E
Ph
Cl
Al
2
O
3
Ph
Cl
Isomère E
H

On observe ensuite un équilibre entre les deux isomères. La réaction tend à
favoriser le produit thermodynamique, puisqu'il est plus stable.
On observe alors sur le diagramme énergétique :
Remarque : On peut par ailleurs calculer la variation d'énergie entre le produit
cinétique et le produit thermodynamique à partir de leur constant d'équilibre, et
inversement.
Ex : On a deux fois plus de produit thermodynamique que cinétique :
On a ainsi :
∆G
0
= - RT x ln K
eq
= -8,8 kJ
Ph
Cl
Ph
Cl
Isomère E Isomère Z
Plus stable
Ph
Cl
H
+
H
+
H
H
alcyne
Produit
cinétique
Produit
thermodynamique
Intermédiaire
Première
réaction
Isomérisation
1
/
4
100%