Cours - Le cours de physique

L'Univers. Chapitre 21 (ions). Cours. 2de
Comment les ions monoatomiques sont-ils constitués ?
I. Les particules constituant les ions monoatomiques.
Les ions sont des atomes qui ont gagné ou perdu un ou plusieurs électrons, ils sont donc électriquement
chargés.
On écrit en exposant (en haut à droite) le signe de la charge électrique précédé du nombre de charges
électriques c’est-à-dire le nombre de fois la charge électrique élémentaire
e
(avec
e
= 1,6 × 10-19 C).
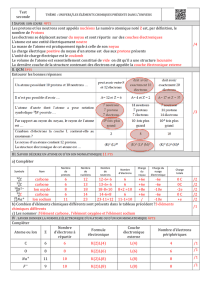
Exercice : Que devient un atome de béryllium
9
4Be
ou Be s’il perd 2 électrons ? Combien vaut sa charge ?
Un atome de béryllium
9
4Be
contient 4 protons, 9-4=5 neutrons et 4 électrons (car il est électriquement neutre).
S'il perd 2 électrons il contient 4 protons, 5 neutrons et 2 électrons et est noté
92
4Be
ou Be2+ . C’est un ion ayant
2 charge + (2 charges électriques élémentaire positives), sa charge est 2
e
= 2 1,6×10-19 = 3,210-19 C .
Un ion chargé positivement est un cation. Un ion chargé négativement est un anion.
Du fait que l’essentiel de la masse est concentrée dans le noyau, la masse de l’ion monoatomique (comme celle
de l’atome) est environ
p
Am
.
Exemple : La masse d'un atome de magnésium 24 (
24
12Mg
) est
27 26
24 24 1,7 10 4,1 10 kg
p
mm
.
La masse d'un ion
24 2
12Mg
est aussi 4,1 10 –26 kg (car les 2 électrons perdus sont de masse négligeable).
Exemple : L'ion chlorure 17Cl- a 17 protons (et a gagné 1 électron par rapport à l'atome) il a donc 18 électrons ;
sa structure électronique est (K)2 (L)8 (M)8 . Il a 8 électrons externes.
Exercice : Déterminer le nombre d'électrons externes de l'ion magnésium 12Mg2+.
L'ion magnésium 12Mg2+ a 12 protons (et a perdu 2 électrons par rapport à l'atome) il a donc 10 électrons ; sa
structure électronique est (K)2 (L)8 . Il a 8 électrons externes.
II. Règle du duet et de l’octet.
Les gaz nobles (aussi appelés gaz rares) sont les éléments de la dernière colonne de la classification périodique
des éléments.
Les atomes de gaz nobles sont très stables chimiquement, ils ne réagissent pas.
On remarque que ces atomes chimiquement stables ont leur couche électronique externe saturée.
Règle du duet et de l’octet :
Les éléments chimiques ont tendance à avoir la même structure électronique que les atomes de gaz nobles les
plus proches (du point de vue du numéro atomique) ; c’est à dire 2 électrons (un duet) sur leur couche externe K
(pour les éléments ayant de 1 à 5 protons) ou 8 électrons (un octet) sur leur couche externe (pour les éléments
ayant plus de 5 protons).
L’ion monoatomique formé par un élément est celui qui répond à la règle du duet et de l'octet .
Exemple : L’atome de fluor (Z=9) de structure électronique (K)2 (L)7 a tendance à avoir un octet d’électrons (c’est-
à-dire 8 e- externes) ; C'est à dire la structure électronique (K)2 (L)8 identique à un atome de gaz noble ; Pour cela
il peut gagner 1 e- et devenir l’ion F-.
Exercice : Déterminer l’ion monoatomique que peut devenir l’atome de lithium 3Li.
L'atome de lithium (Z=3) de structure électronique (K)2 (L)1 a tendance à avoir un duet d’électrons (c’est à dire 2
e- externes sur la couche K) ; C'est à dire la structure électronique (K)2 identique à un atome de gaz noble ; Pour
cela il peut perdre 1 électron pour devenir l’ion Li+.
III. Quelques tests d’identification d’ions.
Ion
Cu2+
Fe2+
Fe3+
Zn2+
Cl-
Réactif
soude
soude
soude
soude
solution de nitrate d’argent
Résultat
précipité bleu
précipité vert
précipité rouille
précipité blanc
précipité blanc
La soude est une solution aqueuse d’hydroxyde de sodium.
1
/
1
100%