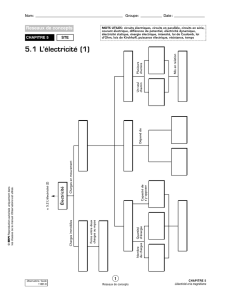
Remplissez le tableau suivant qui montre la représentation et les

3
Verdicts et diagnostics
CHAPITRE 3
L’énergie et ses manifestations
©
ERPI
Reproduction et modifications autorisées uniquement
dans les classes où le manuel Observatoire est utilisé.
CORRIGÉ
Observatoire / Guide
11801-B
Revision pour l’examen de fin d’année
En rouge : exercices pour le STG
En jaune : exercices pour le STE

3
Verdicts et diagnostics
CHAPITRE 3
L’énergie et ses manifestations
©
ERPI
Reproduction et modifications autorisées uniquement
dans les classes où le manuel Observatoire est utilisé.
CORRIGÉ
Observatoire / Guide
11801-B
Univers matériel (chapitre 1 à 5)
1. Remplissez le tableau suivant qui montre la représentation et les caractéristiques de différents
modèles atomiques.
Modèle
atomique
Représentation
Caractéristiques du modèle
Dalton
Les atomes sont des particules
extrêmement petites et indivisibles.
Rutherford
Thomson
Les atomes sont des particules
extrêmement petites, positives,
parsemées de petites particules
négatives, les électrons.
Les atomes sont constitués d’un noyau petit,
massif et positif et d’électrons qui gravitent
autour de ce noyau.

3
Verdicts et diagnostics
CHAPITRE 3
L’énergie et ses manifestations
©
ERPI
Reproduction et modifications autorisées uniquement
dans les classes où le manuel Observatoire est utilisé.
CORRIGÉ
Observatoire / Guide
11801-B
Rutherford-
Bohr
Modèle
atomique
simplifié
2. Le modèle atomique a évolué au fil du temps en fonction de différentes observations et
découvertes. Indiquez la conclusion qu’il est possible de tirer pour chacun des faits observés
ci-dessous.
a) John Dalton observa que les éléments ont des propriétés différentes.
b) Ernest Rutherford observa que seules quelques particules alpha sont déviées par
une mince feuille d’or.
c) Niels Bohr observa qu’un élément chauffé émet de la lumière selon certaines longueurs
d’onde précises.
Les atomes sont constitués d’un noyau petit,
positif et d’électrons qui gravitent autour de
ce noyau selon des orbites spécifiques.
Le noyau des atomes est constitué de
particules positives, les protons, et de
particules neutres, les neutrons. Des
électrons gravitent autour de ce noyau selon
des orbites spécifiques.
Les atomes d’un élément diffèrent de ceux des autres éléments.
L’atome est constitué d’un noyau très dense et très petit.
Les électrons gravitent autour du noyau selon des orbites spécifiques.

3
Verdicts et diagnostics
CHAPITRE 3
L’énergie et ses manifestations
©
ERPI
Reproduction et modifications autorisées uniquement
dans les classes où le manuel Observatoire est utilisé.
CORRIGÉ
Observatoire / Guide
11801-B
d) Joseph John Thomson observa que les rayons cathodiques sont attirés par la borne
positive d’un champ électrique.
e) Ernest Rutherford observa que la plupart des particules alpha sont capables de passer
au travers d’une mince feuille d’or sans être déviées.
f) Joseph John Thomson observa que les rayons cathodiques peuvent mettre en mouvement
un moulinet inséré à l’intérieur du tube.
g) James Chadwick découvre une nouvelle particule provenant du noyau, mais qui n’est pas
déviée par un champ électrique.
3. Indiquez quel modèle atomique le plus ancien permet d’expliquer chacun des faits énoncés
ci-dessous.
a) Les particules alpha sont déviées par les atomes.
b) Au cours d’une transformation, aucune matière ne se perd ni se crée.
c) On observe des phénomènes d’électricité statique lorsque des électrons sont transférés
d’un corps à un autre.
d) L’hydrogène émet un spectre différent de celui de l’hélium.
e) Les isotopes d’un même élément ont des masses différentes.
f) La matière est constituée de particules extrêmement petites.
g) Le noyau des atomes est petit et massif.
Les rayons cathodiques sont négatifs.
L’atome est essentiellement constitué de vide.
Les rayons cathodiques sont constitués de particules.
Le noyau comporte des particules neutres qui permettent de maintenir ensemble les protons de
charges positives.
Le modèle atomique de Rutherford.
Le modèle atomique de Rutherford.
Le modèle atomique de Dalton.
Le modèle atomique simplifié.
Le modèle atomique de Rutherford-Bohr.
Le modèle atomique de Thomson.
Le modèle atomique de Dalton.

3
Verdicts et diagnostics
CHAPITRE 3
L’énergie et ses manifestations
©
ERPI
Reproduction et modifications autorisées uniquement
dans les classes où le manuel Observatoire est utilisé.
CORRIGÉ
Observatoire / Guide
11801-B
h) Les électrons tournent à grande vitesse selon des orbites spécifiques.
4. Qu’est-ce qui différencie un atome d’hydrogène d’un atome d’hélium ?
5. Les électrons d’un atome d’oxygène sont-ils différents des électrons d’un atome de cuivre ?
Expliquez votre réponse.
6. Qui suis-je ?
a) Je suis le nom que l’on donne à chaque colonne du tableau périodique.
b) Je suis le nom que l’on donne à chaque rangée du tableau périodique.
c) Je suis une classe d’éléments à gauche du tableau périodique.
d) Je suis une classe d’éléments qui se situe autour de l’escalier du tableau périodique.
e) Je suis une classe d’éléments dans laquelle se trouvent à la fois des éléments solides,
liquides ou gazeux aux conditions ambiantes de température et de pression.
7. Après avoir observé un élément pur, Catherine note les résultats suivants :
Caractéristique
Observation
ÉTAT
Solide
Conductibilité électrique
OUI
Conductibilité thermique
Oui
Malléabilité
Non
Éclat
Non
S’agit-il d’un métal, d’un non-métal ou d’un métalloïde ? Expliquez votre réponse.
Non, puisque l’électron est une particule élémentaire de l’atome, commune à tous les atomes.
Seul leur nombre varie d’un atome à l’autre.
Leur nombre de protons, d’électrons et de neutrons est différent.
Le modèle atomique de Rutherford-Bohr.
Une famille ou un groupe.
Une période.
Les métaux.
Les non-métaux.
Les métalloïdes.
Il s’agit d’un métalloïde puisqu’il a à la fois certaines propriétés des métaux et des non-métaux.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
1
/
64
100%