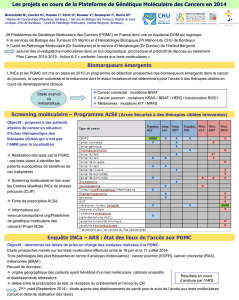
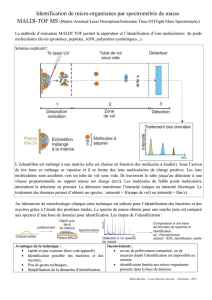
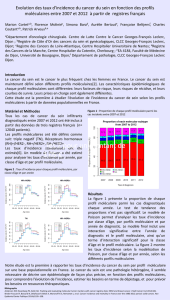
Accès aux tests moléculaires EGFR, RAS et BRAF /Résultats d`une

APPUI À LA DÉCISION
JANVIER 2016
ACCÈS AUX TESTS
MOLÉCULAIRES
EGFR, RAS ET BRAF
/ Résultats d’une enquête
dans 5 régions françaises

2
ACCÈS AUX TESTS MOLÉCULAIRES EGFR, RAS ET BRAF
/RÉSULTATS D’UNE ENQUÊTE DANS 5 RÉGIONS FRANÇAISES
Ce document doit être cité comme suit : ©Accès aux tests moléculaires EGFR, RAS et BRAF /Résultats d’une enquête dans 5 régions françaises, appui à la
décision, INCa, janvier 2016
Ce document est publié par l’Institut national du cancer qui en détient les droits. Les informations figurant dans ce document peuvent être réutilisées
dès lors que : (1) leur réutilisation entre dans le champ d’application de la loi N°78-753 du 17 juillet 1978 ; (2) ces informations ne sont pas altérées et
leur sens dénaturé ; (3) leur source et la date de leur dernière mise à jour sont mentionnées.
Ce document est téléchargeable sur e-cancer.fr
L’Institut national du cancer (INCa) est l’agence d’expertise sanitaire et scientifique en cancérologie chargée de coordonner
la lutte contre les cancers en France.
Depuis 2003, la lutte contre le cancer en France est structurée autour de plans nationaux visant à mobiliser tous les acteurs
autour de la prévention, du dépistage, des soins, de la recherche et de l’accompagnement du patient et de ses proches. Le Plan
cancer 2003-2007 a dressé une première stratégie globale de lutte contre le cancer ; le deuxième (2009-2013) a introduit la
notion de prise en charge personnalisée.
Le Plan cancer 2014-2019 a pour ambitions de donner à chacun, partout en France, les mêmes chances de guérir et de mettre plus
rapidement encore les innovations au service des malades. Il comprend 17 objectifs regroupés autour de quatre grandes priorités de
santé :
l Guérir plus de personnes malades
l Préserver la continuité et la qualité de vie
l Investir dans la prévention et la recherche
l Optimiser le pilotage et les organisations
Le Plan cancer s’inscrit dans la mise en œuvre de la Stratégie nationale de santé et de
l’Agenda stratégique pour la recherche, le transfert et l’innovation « France-Europe 2020 ».
Ce guide répond à l’ Action 6.2 : Conforter l’accès aux tests moléculaires
« S’assurer avec l’aide des ARS que l’ensemble des patients sur le territoire
national (incluant les DOM), ont effectivement accès aux tests moléculaires
de génétique constitutionnelle et de génétique tumorale, quels que soient les
praticiens et établissements qui les prennent en charge. Plus particulièrement
en ce qui concerne les DOM, assurer la continuité territoriale par des
partenariats avec des plateformes métropolitaines. »
Pour en savoir plus et télécharger le Plan cancer : e-cancer.fr
Cancer
Plan
2014-2019

Ont participé à l’élaboration de ce document :
Etienne LONCHAMP, INCa
Frédérique NOWAK, INCa
Danièle LEGRAND, ARS Ile-de-France
Annick MORVAN, ARS Ile-de-France
Marie-Laure NEVEUX, ARS Ile-de-France
Arnaud JOAN-GRANGE, ARS Aquitaine
Béatrice JACQUEME, ARS PACA
Philippe VAGNER, ARS Languedoc-Roussillon
Catherine MALBOS, ARS Rhône-Alpes
Annick GALVIN, ARS Rhône-Alpes
ACCÈS AUX TESTS MOLÉCULAIRES EGFR, RAS ET BRAF
/Résultats d’une enquête dans 5 régions françaises
3

TABLE DES MATIÈRES
MÉTHODE .............................................................................................................................................. 9
1. ENQUÊTE PLATEFORMES ................................................................................................................ 9
2. ENQUÊTE ÉTABLISSEMENTS .......................................................................................................... 10
RÉSULTATS ........................................................................................................................................... 11
1. PARTICIPATION AUX ENQUÊTES ................................................................................................... 11
2. ACCÈS AUX TESTS MOLÉCULAIRES ................................................................................................ 13
2.1. CANCER COLORECTAL ................................................................................................................... 13
2.2. CANCER DU POUMON .................................................................................................................. 15
2.3. MÉLANOMES ................................................................................................................................ 17
3. UTILISATION DES RÉSULTATS DES TESTS POUR LE CHOIX DE LA LIGNE DE TRAITEMENT
EN COURS .................................................................................................................................... 19
4. CIRCUITS DE PRESCRIPTION DES TESTS ......................................................................................... 20
5. DÉLAI DE RÉALISATION DES TESTS MOLÉCULAIRES........................................................................ 21
5.1. DÉLAI DE RÉCEPTION DES PRÉLÈVEMENTS .................................................................................... 22
5.2. DÉLAI DE RÉALISATION DES TESTS ................................................................................................ 23
5.3. DÉLAI DE RETOUR DES RÉSULTATS AU CLINICIEN .......................................................................... 24
ANNEXE 1 : ACTIVITÉ POUR LA RECHERCHE DE MARQUEURS PRÉDICTIFS DE LA RÉPONSE
À UNE THÉRAPIE CIBLÉE ....................................................................................................................... 28
ANNEXE 2 : RÉPARTITION DES 28 PLATEFORMES DE GÉNÉTIQUE MOLÉCULAIRES.................................. 29
ANNEXE 3 : RÉPARTITION DES PATIENTS SELON LE TYPE D’ÉTABLISSEMENT .......................................... 30
ANNEXE 4 : QUESTIONNAIRE PLATEFORMES ......................................................................................... 31
ANNEXE 5 : QUESTIONNAIRE ÉTABLISSEMENTS .................................................................................... 32
ACCÈS AUX TESTS MOLÉCULAIRES EGFR, RAS ET BRAF
/Résultats d’une enquête dans 5 régions françaises
4

ACCÈS AUX TESTS MOLÉCULAIRES EGFR, RAS ET BRAF
/Résultats d’une enquête dans 5 régions françaises
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%