Chapitre 1 : généralités

Chp1 généralités 1 - 1
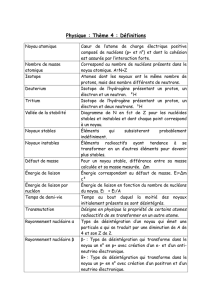
Chapitre 1 : généralités
1.1 Constitution de la matière
1.1.1 Les particules élémentaires de matière : électrons & nucléons (quarks)
Les atomes sont formés d’électrons chargés négativement gravitant autour d’un noyau positif1; les
noyaux sont formés de nucléons : protons positifs et neutrons électriquement neutres.
Molécules
Bien que les protons se repoussent par interaction électrique, les noyaux sont stables car s’exerce
entre les nucléons une force de cohésion très attractive, beaucoup plus intense que la répulsion
électrique mais dont la portée est très courte : ≈2 10−15 m.
Force nucléaire entre 2 p >>>>
Force nucléaire forte entre un proton et un neutron
+ +
Répulsion électrostatique
Les nucléons sont des particules composites comprenant 3 particules considérées à l’heure actuelle comme
ponctuelles : les quarks. L’interaction qui s’exerce, dans chaque nucléon, entre ces quarks, est l’interaction
FORTE "de couleur"; la force de cohésion nucléaire est le résiduel de cette interaction à l’extérieur du
nucléon. C’est la même situation qu’en physique atomique : l’interaction entre les atomes d’une molécule est
le résiduel, à l’extérieur des atomes, de l’interaction électrique qui s’exerce entre le noyau et les électrons qui
l’entourent; cela est vrai qu’il s’agisse d’électro-valence (échange d’un électron entre 2 atomes) ou de co-
valence (mise en commun d’électrons par 2 atomes). Il est à noter que les quarks n’existent pas à l’état libre
et qu’ils portent des charges électriques fractionnaires (+2e/3 pour le quark u "up" & −e/3 pour le quark d
"down"). Bien qu’étant constitués de quarks, protons (uud) et neutrons (udd) sont considérés comme les
constituants de base du système nucléaire (de même que les atomes sont les constituants de base des gaz
rares).
1Découverte de la radioactivité /Becquerel-1896, découverte de l'électron /Thomson -1897, découverte d’un noyau
minuscule au centre de l’atome /Rutherford-1911 & découverte des neutrons /Chadwick-1932.

Chp1 généralités 1 - 2
1.1.2 Les 4 interactions fondamentales
Toute action à distance s’effectue par
échange d’énergie. Au niveau
microscopique, 2 systèmes qui interagissent
le font par échange de particules transportant
une quantité bien définie d’énergie ou
quantum : E = hν.
π p n
♦ Interaction électromagnétique : assure la cohésion de l'atome; la particule échangée dans cette
interaction est le photon (désigné par la lettre grecque γ), de masse au repos nulle et d'énergie E=hν
(h = constante de Planck = 6,63 10−34 J.s ou h = h/2π = 6,58 10−22 MeV.s).
♦ Interaction nucléaire forte : assure la cohésion du noyau; les particules échangées sont des
"mésons - pions" (désignées par la lettre grecque π et possédant une masse au repos valant ≈ 1/10 de la
masse du nucléon).
♦ Interaction nucléaire faible : beaucoup moins intense que l’interaction forte et que l’interaction
électromagnétique et de très courte portée; elle joue un rôle dans les phénomènes de radioactivité:
elle se manifeste dans la désintégration bêta de noyaux instables. Les particules échangées à ce niveau
sont des particules très massives : les BOSONS W+ ou W−, dont les masses valent ≈100 fois la masse du
nucléon.
désintégration du neutron libre
♦Interaction gravitationnelle: toujours attractive, agit au niveau de la masse des particules; elle est
responsable de la chute des corps et du mouvement des planètes; elle est de beaucoup la moins intense des 4
interactions. Les particules échangées seraient des GRAVITONS sans masse qui restent hypothétiques.

Chp1 généralités 1 - 3
Tableau 1.1 les 4 interactions fondamentales
Interaction Agit sur
particules Rôle Particule échangée
= boson Portée Intensité
relative
Nucléaire forte Nucléons Cohésion du noyau Bosons π Noyau
(≈2 fm) 1
Nucléaire faible Toutes Radioactivité β Bosons W+ W−
≈ 2 10−3 fm ≈10−13
Electromagnétique Chargées Cohésion de l'atome
"Radioactivité γ" Photon γ Infinie ≈10−2
gravitationnelle Toutes Mouvement planètes Gravitons ? infinie 10−38
1.2 Fiche signalétique de l'atome et du noyau
@ L’atome contient 2 types de particules : électrons et nucléons (protons & neutrons).
Tableau 1.2 : contenu d'un atome
Particule Nombre charge
électrique masse au repos spin
Electron
proton
neutron
Z
Z
N = A−Z
−e
+e
0
0,511 MeV/c2
938,28 MeV/c2
939,57 MeV/c2
½
½
½
B Particules = fermions
auxquels s'applique le
principe d'exclusion de
Pauli
avec |e| = 1,6 10−19C
Z = nombre atomique = caractéristique de l'élément chimique
Exemples : Z =1 B hydrogène
Z = 6 B carbone
Z = 16 B soufre
Z = 92 B uranium
A = nombre de masse = nombre de nucléons : Z protons et N = (A-Z) neutrons
A = Z + N
@ le noyau contient : Z protons et N neutrons B symbole du noyau (et de l'atome): Z
AX
@ la molécule s'écrit : Z
A où n désigne le nombre d'atomes X qu'elle contient.
n
X
@ on peut aussi écrire en haut à droite l'état d'ionisation de l'atome : Z
AX
+
+
@ par généralisation, on écrit souvent : pour le proton : 1
1
p
pour le neutron :
0
1n
pour l'électron :
−
1
0e & pour le positron : +.
1
0e
Relations importantes :
♦ mn > mp avec mn − mp = 1,29 MeV/c2 B mn − mp > me (0,511 MeV/c2)
♦ MH = mp + me = 938,791 MeV/c2 B mn > MH

Chp1 généralités 1 - 4
1.3 Unités et ordres de grandeur
1.3.1 Dimensions nucléaires
Rappelons que la dimension de l’atome d’hydrogène est de l’ordre de 10−10 m (1Å).
Quant aux rayons des noyaux, ils sont de l’ordre quelques fm (1 fermi ou femtomètre [fm] = 10-15
m). Ceci se déduit par exemple de la variation de la densité volumique de charge du noyau en
fonction de la distance radiale (figure de gauche).
Le nucléon a quant à lui une dimension de l'ordre de 1 fm.
@ Ainsi, si l'atome se dilatait à une distance de 100m (terrain de foot), on
observerait le noyau comme un "petit pois" et le nucléon comme un
"dixième de petit pois".
R0
Q/V
R(fm) 5
Le rayon nucléaire varie avec le nombre de masse A selon la loi approximative :
A1/3
R0 = r0 A1/3 avec r0 = Cte ≈1,2fm, comme le prouve la figure de droite.
1.3.2 Densités nucléaires
La densité nucléaire se définit comme le nombre de nucléons par unité de volume : c’est une
quantité presque constante pour tous les noyaux : 0,17 1045 nucléons/m3 = 0,17 nucléons/fm3.
N.B. Cette quantité représente une masse volumique énorme d'environ 2,7 1017 kg/m3. Comparée à la masse
volumique la plus élevée d’un corps macroscopique (≈22500 kg/m3), on constate que les noyaux sont 13
ordres de grandeur plus denses. La masse volumique de l’atome, dont le rayon est 10 000 fois plus grand que
celui du noyau est de l’ordre de 200 000 kg m−3.
1.3.3 Energies
♦ Dans les molécules, les énergies de liaison des atomes vont de quelques eV à 10 eV.
Exemples : liaison H−H dans molécule H2 : 4,52 eV / liaison C−H dans les alcanes : 4,18 eV
liaison O=O : 5,08 eV / liaison N≡N : 9,76 eV.
♦ Au-dessous se situent les énergies de la théorie cinétique des gaz et des neutrons dits
“thermiques” (énergie cinétique la plus probable de 0,025 eV @20°C).
♦ Au-dessus, on trouve les rayons X qui sont les photons émis lors des transitions entre niveaux
électroniques (ou niveaux atomiques), ils ont des énergies de quelques keV à quelques centaines de
keV.

Chp1 généralités 1 - 5
♦ La gamme du MeV est celle de la physique nucléaire, des phénomènes dits de radioactivité :
émission de rayonnements α, β ou γ.
Tableau 1.3 : nature des rayonnements
Particules α
Particules β
Particules γ
Noyaux d'hélium (2p + 2n)
Electrons (β−) ou antiélectrons (β+)
Photons provenant de transitions nucléaires (B énergie ≈ MeV)
Extrait de la thèse de Mme Curie, 1904:
déflexion des rayonnements α β γ
dans un
champ magnétique
En physique des particules, on sonde la matière (distances actuellement explorées de ≈10−3 fm) en
utilisant des particules ayant une énergie de l’ordre de 1000 GeV (14 TeV avec le nouveau
collisionneur LHC du CERN). 1 kilo eV (1 keV) = 103 eV 1 Méga eV (1 MeV) = 106 eV
1 Giga eV (1 GeV) = 109 eV 1 Téra eV (1 TeV) = 1012 eV
1.3 Nomenclature : isotopes, isobares, isotones et nuclides
♦ Pour un même élément (même Z, même nombre de protons) il peut arriver que plusieurs noyaux
existent, qui diffèrent seulement par le nombre de neutrons (@ A diffère). Ces noyaux ont des
masses différentes mais appartiennent tous à la même “case” du tableau de Mendeleïev. On qualifie
les atomes correspondants d’isotopes des mots grecs isos (égal) et topos (lieu).
Exemples: 1/ l'hydrogène naturel contient du 1
1(99,985 %), du deutérium 1
2 (0,015%) et des traces
de tritium 1
3 radioactif. H H
H
2/ le carbone naturel contient : 6
12 (98,89 %) 6
13 (1,11 %) et des traces de 6
14 radioactif.
C C C
3/ l'uranium naturel contient 3 isotopes radioactifs : 92
238 (99,275 %) 92
23 (0,720 %) 92
234 (0,005 %).
U5U U
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%