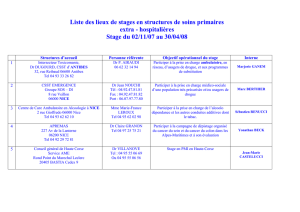
CHIMIE GENERALE CHAPITRE I. Structure de l - E

1
J. Golebiowski,
Université deNice 1
CHIMIEGENERALE
J.GOLEBIOWSKI
PCEM1
www.unice.fr/lcmba/golebiowski
ouvragesderéférences:
PaulArnaud:CoursdeChimiePhysique
Universitéenligne:www.unice.fr/uel
J. Golebiowski,
Université deNice 2
CHAPITREI.
Structuredel’atome
Objectifs:
•
Connaîtreleprincipedelamécanique
quantique
•
Définirl’absorptionetl’émissiond’énergie
•
Connaîtrelesniveauxd’énergiedesélectrons
dansl’atome
J. Golebiowski,
Université deNice 3
Qu’estcequ’unatome?
• Atome
Centrésursonnoyau,considérécommefixe
Contient
desprotons(q=+1u.a.oue)
desneutrons(q=0e)
desélectrons(q=1e)
J. Golebiowski,
Université deNice 4
X
q
A
Z
X:élémentconsidéré
Z:nombredepr otons
numéroatomique
A:nombredemasse(A=Z+N)
N:nombredeneutrons
q:nombredecharges
Notations
J. Golebiowski,
Université deNice 5
Notionsd’élément
• Caractériséparsonnom(X)ousonnuméro
atomique(Z)C(carbone)estl’élément12
• Unisotopepossèdeunnombredeneutronsdifférent.
14
Càdeuxneutronsdeplusque12
C
• Unionestuneentitéchargée,ondistingue
lescations:chargéspositivement(onperduunou
desélectrons)
lesanions:chargésnégativement(gain
d’électron(s)) J. Golebiowski,
Université deNice 6
Electromagnétisme
• Lerayonnementélectromagnétiqueestune
formed’énergiequel’onpeutcaractériser
commeunphénomènevibratoire.
Ilestreprésentépar:
savitessec,enm.s
1
safréquence n,enHz(ou/sous
1
)
salongueurd’onde l,enm
•c= l.n ou l = c/n

2
J. Golebiowski,
Université deNice 7
Interactionrayonnement/matière
• Cetypederayonnementestobservé
expérimentalementdepuislamatière,sousdeux
formes:
Emission.(production)
tubeaunéon,ferchauffé«àblanc»,antennes
TV
Absorption.
échauffementd’uncorps,radiographieX
J. Golebiowski,
Université deNice 8
Interactionrayonnement/matière
• Letracédelafréquenceenfonctionde
l’intensité(force)durayonnementpeutêtreun
spectre
continuoudiscontinu(ouderaies).
n n
intensité intensité
Ex.arcenciel Ex.radioFM
J. Golebiowski,
Université deNice 9
Interactionrayonnement/matière
• Expérimentalement,lesatomesémettentun
spectrediscontinu(deraies),lorsdeleur
excitation.ex:chauffage
• Achaqueatomeouélémentchimique,
correspondunspectrederaiesàdeslongueurs
d’ondebiendéfinies.
Lesselsdesodiumchauffésproduisentune
lumièrejaune,lepotassiumemetdansle
violetetlebaryumdanslevertclair.
• Pourquoi?...
J. Golebiowski,
Université deNice 10
Lanotiondequanta
• Lathéoriedesquanta:l’échanged’énergie
entrelamatièreetunrayonnement
électromagnétiquenepeutavoirlieuque
via
desquantitésdéfinies.
Cesquantitéssontdesmultiplesd’une
quantité d’énergieminimale,appelée
« QUANTUM»ougraind’énergie
J. Golebiowski,
Université deNice 11
L’énergieestdiscontinue
• L’énergieetlamatièresontdoncdiscontinues.
• Unrayonnementpeutalorsêtrecaractérisépar
unfluxdeparticulesayantdesénergies
quantifiées,les« PHOTONS».
Energied’unphotonoud’unquanta:E= hn
h:constantedePlanck:6,626.10
34J.s
J. Golebiowski,
Université deNice 12
E= hn
• Siunatomeabsorbeuneénergieparun
rayonnementdefréquence n,sonénergieaugmente
deE
absorbée= hn.
• Maislesatomesabsorbentl’énergieselondes
valeursbiendéfinies,quantifiées.

3
J. Golebiowski,
Université deNice 13
Notiondedualité onde/corpuscule
• Lechampélectromagnétique(ondulatoireselonla
conceptionclassique)manifestedanscertaines
conditionsunenaturecorpusculair e(photon)
• Lesélectrons,
apriori
denaturecorpusculaire,
peuventproduiredeseffetstypiquesd'unenature
ondulatoire(onde).
J. Golebiowski,
Université deNice 14
Notiondedualité onde/corpuscule
• Atouteparticulecorpusculairedemassemetde
vitessev,peutêtreassociéeuneondedematièrede
longueurd’onde l,telleque:
• l=h/mv
• lestlalongueurd'ondede
deBroglie
Lesélectronspeuventêtredéfiniscommedesondes!
J. Golebiowski,
Université deNice 15
L’atomequantique
• Dansl’atome,leoulesélectronssontdéfinispardes
fonctionsd’ondes y etleurénergie(E)estdonnéeparla
résolutiondel’équationdeSchrödinger :
• H.y=E.y
Résolutiondecetteéquation:
4paramètrespermettentladescriptiondusystème
électroniquedansunatome. y(n,l,m,s).
Lesniveauxd’énergiesontquantifiésE(n,l,m,s).
Lesvaleursd’énergiedansl’atomesontnégatives
J. Golebiowski,
Université deNice 16
L’atomed’hydrogène
• Les4paramètresseréduisentàunseul:n.Onnote
l’énergie« E
n
»
• Enl’absenced’actionextérieure,l’électronse
trouvesurleniveauleplusbas:l’état
FONDAMENTAL,sinononparled’étatEXCITE
E¥=0
E4
E3
E2
E1
unseulélectron
Étatfondamental
ÉtatSexcitéS
J. Golebiowski,
Université deNice 17
Transitionsdansl’atome
• Lorsdestransitions,l’échanged’énergieàlieu
sousformed’ondeélectromagnétique(photons)
• ExcitationE1 ® Ennécessiteexactement
DE=En E1
Lesystèmeredescendensuitespontanément
versE1,enEMETTANT DE=En E1= hn
:spectred’émissionquantifié
Emissiondephoton=Emissiondecouleur!
J. Golebiowski,
Université deNice 18
Exemplesdetransition
E¥=0
E4
E3
E2
E1
E=hn
= En-E1
photon
E¥=0
E4
E3
E2
E1
Étatfond. Étatexcité:
instable
1/ABSORPTION
quantifiée
E4
E3
E2
2/EMISSION
quantifiée
E= En-E1
= hn
E1
photon
Étatfond.
E¥=0
émission

4
J. Golebiowski,
Université deNice 19
Extensionaux hydrogénoïdes
• Si1seule
formuleempiriquepermettantderetrouverles
valeursdesénergiessansrésoudreHy=Ey
En=K.Z²/n²
Z
:N°atomique,
n
:niveaud’énergiede
l’e dansl’atome
K:constante(13,6eVou2,179.10
18 J)
J. Golebiowski,
Université deNice 20
Hydrogénoïdes
• Niveauxd’énergie
E
K.Z²
K.Z²/4
K.Z²/16
K.Z²/9
K.Z²/¥=0 n=¥
n=4
n=3
n=2
n=1 fondamental
excités
ETATIONISE
électronà l’infinidunoyau
H:Z=1
He
+:Z=2
Li
2+:Z=3
...
Excitation1®3dansHe
+
DE=E3E1
=K.2²/9+K.2²
=K.2² (1/9 1)
=48,36 eV=7,75.10
18J
sousformedephoton(lumière)...
DE=hn = hc/l
n =E(Joules!)/h(J.s)
=1,17.10
16 Hz
l=c/n=2,5610
8m(UV)
J. Golebiowski,
Université deNice 21
Aretenir
• Lesélectronssontdesparticulesquantiques
Ilsontdesénergiesquantifiéesdanslesatomes
Ilspeuventêtrereprésentéspardesfonctions
d’onde,définiespar4paramètres,ounombres
quantiques
Lepassaged’unniveaud’énergieàunautrepeut
sefaireparabsorption(augmentationde
l’énergie)ouparémission(descenteenénergie)
d’uneondeélectromagnétique(photon)
E=hn= hc/l= DEdansl’atome
J. Golebiowski,
Université deNice 22
Aretenir
• Siunseule :hydrogénoïde
Formuleempiriquedonnantles
n
niveauxd’énergie
dansl’atome
En=K.Z²/n² K=13,6 eVou2,179.10
18 J
J. Golebiowski,
Université deNice 23
Systèmespolyélectroniques
• L’étatd’une dansunatomeestdéfinipar4
nombresquantiques,
• Lesvaleursdecesnombressontliéeslesunesaux
autres
n:principal n>1 énergie
l
:secondaireouazimutal0<
l
£n1 forme
m:magnétique
l
£m £+
l
direction
s:spin +1/2ou1/2
J. Golebiowski,
Université deNice 24
Lenuageélectronique
• Lese sontdéfiniescommedesondes
Ilsnedontpasparfaitementlocalisablesdans
l’espaceautourdel’atome
• larésolutiondeHy=Eymèneàdesfonctions
propresdel’opérateurH:lesorbitalesatomiques
Ellesontdesformesetdesniveauxd’énergies
différents
Représentéesparles4nombresquantiques

5
J. Golebiowski,
Université deNice 25
n
• Définitleniveaud’énergieoucouche
principale(En)
n=1,2,3,4,5,6….
En
n=1
n=2
n=3
n=4
0 eV
Couche
N
K
L
M
J. Golebiowski,
Université deNice 26
l
Définitlaformedel’espacedanslaquelleon
trouvel’e
Définitlesousniveauoulasouscouched’un
niveaud’énergien(0<
l
£n1)
l=0, s
l=1, p
l=2, d
l=3, f
En
n=1:l=0: 1s
n=2:l=0ou1:2s2p
n=3:l=0ou1ou2:3s3p3d
n=4 4s4p4d4f
0 eV
J. Golebiowski,
Université deNice 27
m
• Définitladirectiondansl’espacedelaformedans
laquellesetrouveune
sil=0alorsm=0:pasdedirectionprivilégiée
(sphère)
lessouscouchesssontuniques
sil=1alorsm=1;0;1:3directions
lessouscouchespsont3(dégénérées)
px,py,pz
Sil=2alorsm=2;1;0;1;2:5directions
lessouscouchesdsont5(dégénérées)
dxy,dxz,dyz, dx²y²,dz² J. Golebiowski,
Université deNice 28
Formedansl’espacedesorbitales
atomiques
OrbitaleAtomique
« s»
OrbitalesAtomiques
« p »
OrbitalesAtomiques
« d»
J. Golebiowski,
Université deNice 29
récapitulatif
• Diagrammeénergétique
n=1
n=3
n=2
1s
2s
3s
2p
x 2p
y 2p
z
3p
x 3p
z 3p
y 3d 3d 3d 3d 3d
n=¥0 eV
J. Golebiowski,
Université deNice 30
RemplissagedesO.A.
• PrincipedePauli(Nobel1945)
dansunatome,ilnepeutyavoirplusd’un
électrondécritparunmêmeensemblede
valeursdonnéesauxquatrenombres
quantiques
Unecasequantique:n,l,mfixés
2p
x:n=2,l=1,m=1
restele4
iemenombrequantique« s»
(spin:+1/2ou1/2)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%