Récepteurs pour l`antigène des lymphocyte

TSSIBG – Immunoglobulines et récepteurs pour l'antigène des lymphocytes B et T
14/10/2013
MARIANI Natacha L2
TSSIBG
G. Pommier
8 pages
Immunoglobulines (Ig/AC) – Récepteurs pour l'antigène des lymphocytes B (BCR) et T (TCR)
Répertoire et reconnaissance
A. Généralités
Tout d'abord, il faut savoir qu'immunoglobulines et anticorps font parti de la même famille de molécules. On
peut retrouver des immunoglobulines (Igs) à la surface des lymphocytes B (LB) où elles sont des récepteurs
pour l'antigène (c'est le BCR). Le TCR qui est à la surface des lymphocytes T (LT) n'est pas une Ig, mais y
ressemble énormément.
Quand un antigène est reconnu comme étranger
au génome de l'organisme, on a le déclenchement
de la réponse immunitaire, innée d'abord. La
réponse innée (ou naturelle) implique des
effecteurs qui sont rapidement mobilisés et qui
vont éliminer de manière pas très spécifique
l'antigène. Les polynucléaires, les cellules NK,
les monocytes ou encore les macrophages vont
reconnaître par exemple des structures comme la
flagelline, l'ARN, l'ADN, le LPS
(lipopolysaccharide). Les effecteurs de la
réponse innée sécrètent des cytokines qui vont
activer un peu plus tard une réponse immunitaire
spécifique au déterminant antigénique
(adaptative). Celle-ci comporte une réponse
immunitaire à médiation cellulaire (LT) ainsi qu'une réponse à médiation humorale (LB – BCR).
Les LB, lorsqu'ils rencontrent l'antigène, vont sécréter des Ig qui sont des anticorps.
1/8
Plan
A. Généralités
B. Les anticorps (= immunoglobulines)
I. Dualité fonctionnelle et structurale des immunoglobulines
II. Régions variables et régions constantes
III. Réaction croisée
IV.Superfamille des immunoglobulines
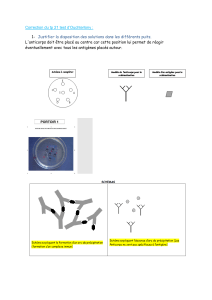
C. Anticorps polyclonaux et monoclonaux
I. La réponse immunitaire physiologique est polyclonale
II. Immunoglobulines monoclonales

TSSIBG – Immunoglobulines et récepteurs pour l'antigène des lymphocytes B et T
B. Les anticorps ( = immmunoglobulines)
I. Dualité fonctionnelle et structurale des immunoglobulines
→ Les anticorps possèdent 2 fonctions :
- Par l'intermédiaire de leur site actif, ils reconnaissent extrêmement spécifiquement l'antigène qui a déclenché
la réponse immunitaire.
- Par l'intermédiaire de la queue de la molécule, les anticorps peuvent fixer des cellules infectées qui ont des
récepteurs pour ce fragment, et qui pourront ainsi être phagocytées par les macrophages. Cette partie de
l'anticorps est également capable de fixer des molécules du système du complément.
L'ensemble du processus est appelé immunisation (si la réponse immunitaire est dirigée contre un antigène qui
est un agent pathogène, ce processus est appelé vaccination).
→ Modèle type d'une IgG (anticorps), immunoglobuline la plus courante dans l'organisme :
- Poids moléculaire = 150 kDa
- Constituée de 2 chaînes lourdes (50 kDa chacune) et de 2 chaînes légères (25 kDa chacune)
- Ces chaînes sont reliées entre elles par des ponts disulfures et des liaisons covalentes énergétiquement faibles,
qui permettent la cohésion de la molécule.
=> pour rompre cette cohésion et séparer les chaînes de la molécule, il faut une réduction ET de l'urée.
La zone charnière (là où se trouvent les ponts disulfures entre les 2 chaînes lourdes) va permettre une certaine
mobilité de la molécule d'anticorps.
→ Dualité structurale de la molécule d'anticorps
À l'extrémité de la chaîne lourde et de la chaîne légère, il y a des structures variables, car c'est là que se situe le
site actif de l'anticorps. Ce site actif va devoir reconnaître à peu près 1010 molécules antigéniques différentes
pour défendre l'organisme. Ceci représente le répertoire B, c'est-à-dire la capacité de l'organisme à fabriquer au
moins 1010 molécules d'anticorps ayant une structure différente au niveau du site actif.
2/8

TSSIBG – Immunoglobulines et récepteurs pour l'antigène des lymphocytes B et T
À côté de ça, il y a les régions constantes des molécules d'anticorps, qui se situent au niveau de la moitié C-
terminale des chaînes lourdes : c'est le fragment Fc. Elles sont le support des fonctions effectrices de la
molécule d'anticorps (fixation du complément, fixation cellules ayant un récepteur spécifique pour ce
complément....). Ces régions sont dites constantes, mais varient un peu selon la fonction effectrice (il y a une
dizaine de fonctions effectrices différentes).
II. Régions constantes et variables des Immunoglobulines
→ Régions constantes des Igs
Il existe 5 types de chaînes lourdes (Fc) donc 5 classes (ou isotypes) d'Igs : IgG(chaîne lourde : γ), IgM(μ),
IgA(α), IgE(ε ), IgD(δ) car les chaînes ont une séquence propre d'acides aminés chacune au niveau du segment
constant des chaînes lourdes. Les IgG se subdivisent encore en 4 sous-classes et les IgA en 2 sous-classes,
toujours sur la base des différences de séquence de la région constante, mais encore plus subtiles.
Il existe 2 types de séquence des parties constantes des chaînes légères (λ et κ) dans les Igs . Une molécule d'Ig
donnée possède soit 2 chaînes légères κ soit 2 chaînes légères λ, jamais les 2 simultanément.
Rapport κ/λ = 2 dans le sérum humain normal
Les 2 chaînes lourdes d'une même molécule d'anticorps sont identiques.
Les 2 chaînes légères d'une même molécule d'anticorps sont identiques.
→ Régions variables des Igs
Chaque molécule d'Ig est une juxtaposition de domaines de 110 acides aminés chacun.
Il y a un domaine pour la région variable de la chaîne légère, un domaine pour la région variable de la chaîne
lourde, 3 domaines pour la partie constante. Chaque domaine possède un pont disulfure intracaténaire (différent
des ponts disulfures intercaténaires qui relient les chaînes lourdes ou qui relient les chaînes légères aux chaînes
lourdes). Si on réduit ces ponts disulfures intracaténaire, on perd irréversiblement l'activité biologique de la
molécule
3/8

TSSIBG – Immunoglobulines et récepteurs pour l'antigène des lymphocytes B et T
On peut isoler ces domaines par des clivages enzymatiques modérés, car ils sont stabilisés par leur pont S-S
intracaténaire :
=> Fab : (fragment qui fixe l'antigène) Il est constitué d'une chaîne légère et de la moitié N-terminale de
la chaîne lourde (PM du fragment = 50 kDa). Il contient les parties constantes ET variables. Une molécule
d'anticoprs contient 2 fragments Fab. L'anticorps est divalent car il possède 2 sites actifs qui sont absolument
identiques. Le fragment Fab est monovalent car il ne possède qu'un site actif. Il reconnaîtra l'antigène, mais les
réaction complète comme la précipitation ou l'agglutination ne se feront pas.
=> Fab'2 : Le pont disulfure est maintenu entre les 2 chaînes lourdes. On a donc les 2 fragments Fab,
donc les 2 sites actifs. Les réactions de précipitation et d'agglutination sont possible.
=> Fc : contient les 2 moitiés C-terminales des chaînes lourdes, ainsi que le pont disulfure inter-chaînes
lourdes. Ce fragment conserve ses propriétés fonctionnelles (fonctions effectrices). En thérapeutique, lors de
l'injection d'anticorps monoclonaux ou d'une sérologie, le receveur développe une réaction immunitaire et
risque de faire un choc anaphylactique dirigé contre ce fragment Fc, ce qui n'est pas le car quand on injecte
uniquement Fab ou Fab2'.
=> Fv : très petit et contient uniquement les parties variables des chaînes lourdes et légères. Il est
toujours capable de reconnaître le déterminant antigénique. Cependant si on dissocie les chaînes lourde et
légère, il y une perte de fonction.
Le site actif de l'anticorps est supporté par l'association des régions variables lourdes et légères. Dans les zones
variables, on trouve des zones hypervariables (= CDR). Ces zones des régions variables des chaînes lourdes et
légères (VH et VL) sont proches dans l'espace et forment le site de liaison à l'antigène. Le site actif des
anticorps (paratope) est le rapprochement dans l'espace des 3 régions hypervariables des domaines VL et VH
de l'anticorps. De nombreuses interactions non-covalentes entre les CDR (résidus déterminant la
complémentarité) et l'épitope antigénique assurent la spécificité et la stabilité du complexe antigène/anticorps.
Le reste de la zone variable, qui varie moins, est appelé la zone « charpente ».
4/8

TSSIBG – Immunoglobulines et récepteurs pour l'antigène des lymphocytes B et T
III. Réaction croisée
La spécificité antigène/anticorps n'est pas absolue. Il peut donc y avoir des réactions croisées.
Par exemple, si un antigène (AG1) est reconnu par un
anticorps (AC1) avec une forte affinité, AC1 peut
reconnaître un déterminant très similaire à AG1 (par
exemple si AG1 est un médicament et AG1' ce même
médicament très peu modifié) mais avec une moins forte
affinité. Autre exemple, si un anticorps reconnaît
l'albumine humaine avec un forte affinité, il pourra
reconnaître l'albumine de souris, du fait de très fortes
homologies entre les 2 albumines, mais là encore avec une
affinité moindre.
IV.
Les Igs liées à la membrane du LB sont les récepteurs spécifiques pour l'antigène (BCR). Ces BCR possèdent
la même spécificité que l'Ig sécrétée spécifique de l'antigène. Lorsque l'antigène va interagir avec le BCR, il va
donner un signal au LB. Ce LB, grâce à ce signal et à l'intervention d'un LT « helper » CD4+, va pouvoir
fabriquer des anticorps après s'être différencié en plasmocyte. Les Igs (anticorps) sécrétés sont de spécificité
unique (la même que celle du BCR).Chaque LB a un BCR qui reconnaît un épitope. Or il faut en reconnaître
1010. Donc dans la moelle osseuse, on a les précurseurs des LB et il y en a au moins 1010 avec chacun une
spécificité anticorps un peu différente. Quand un LB reconnaît un déterminant antigénique, il prolifère
(expansion clonale), se différencie en plasmocyte et sécrète l'anticorps. Ce LB constitue un clone de LB.
Cependant, au cours de la réponse immunitaire il se produit un phénomène appelé la commutation isotypique.
Les mêmes régions variables peuvent être associées à des régions constantes distinctes pour les chaînes lourdes,
entre l'Ig sécrétée et le BCR, chacune avec des fonctions effectrices différentes.Le BCR est généralement une
IgM (au début de la réponse immunitaire) puis une IgG.
5/8
 6
6
 7
7
 8
8
1
/
8
100%