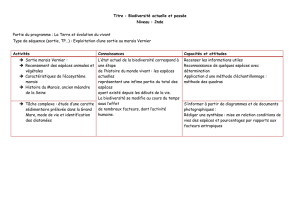
Rapport situation cuivré marais salés_Fev2012

Rapport sur la situation du cuivré des marais salés
(Lycaena dospassosi) au Québec

ii

Direction de l’expertise sur la faune et ses habitats
RAPPORT SUR LA SITUATION DU CUIVRÉ DES MARAIS SALÉS
(LYCAENA DOSPASSOSI) AU QUÉBEC
Par
Éric Domaine
Pour le
Ministère des Ressources naturelles et de la Faune
Faune Québec
Janvier 2012

ii
Référence à citer :
DOMAINE, E. 2012. Rapport sur la situation du cuivré des marais salés (Lycaena dospassosi) au
Québec, ministère des Ressources naturelles et de la Faune du Québec, Faune Québec, 29 pages.
Dépôt légal — Bibliothèque et Archives nationales du Québec, 2012
ISBN : 978-2-550-58248-9 (version imprimée)
978-2-550-58249-6 (version PDF)
Cuivré des marais salés (Lycaena dospassosi)
(Photo : Sylvain Paradis, Agence Parcs Canada)
(Reproduction autorisée)

iii
RÉSUMÉ
Le cuivré des marais salés (Lycaena dospassosi) est un lépidoptère diurne qui se rencontre
uniquement dans les marais salés de l’est du Canada. Au Québec, sa répartition couvre une bande
de 200 km s’étendant de Saint-Siméon à Penouille, en Gaspésie. Sur cet axe, il y a une population
constituée des colonies qui occupent quelques localités connues. Cet insecte est associé à deux
plantes qui semblent essentielles à toutes les étapes de son cycle vital. Ces végétaux sont : la
potentille d’Egede (Potentilla egedei var. groenlandica) qui est sa plante hôte, et le limonium de
Caroline (Limonium carolinianum) qui constitue sa source nectarifère principale. Localement, le
cuivré des marais salés est abondant certaines années, mais cela semble fluctuer selon les étés. Au
Québec, de nouvelles localisations de ce papillon ont été découvertes au cours des dernières
années, laissant croire à une augmentaiton du nombre de sites occupés, mais toujours dans les
limites circonscrites entre Saint-Siméon et Penouille. Les menaces qui peuvent contribuer au
déclin des populations de cuivrés des marais salés proviennent en majorité des activités
anthropiques locales qui ont des conséquences sur les marais. Ce rapport de situation permet de
dresser un bilan des connaissances actuelles sur le cuivré des marais salés au Québec.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%