Température, pression, gaz parfaits

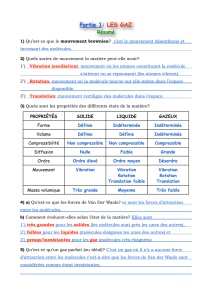
1!
Chaleur, température, pression,"
gaz parfait, diffusion,...!
v 7!9!

2!
La Température T!
Instrument de mesure type: le thermomètre à Hg.!
Calibration: échelle Celsius de température:!
!0 °C l'eau gèle!
!100 °C l'eau bout (au niveau de la mer)!
Autre échelle : Fahrenheit!
!!T
C = (TF - 32)5/9!
Echelle physique : Kelvin : 0 K est le "zéro absolu"!
!!T = TC - 273,15 ....!
Quand T=0 K les molécules sont immobiles (E cinétique=0) !

3!
Origine microscopique de la "chaleur"!
Le mouvement Brownien!
est un témoignage!
de l'agitation thermique!
des molécules.!
Le petit grain (bleu) en suspension est!
excités par la collision avec les!
molécules du liquide (points rouges).!
trajectoire d'une!
particule!

4!
La Pression P!
Considérons un fluide en équilibre a) (p. ex. une quantité d'eau!
à 1 m de profondeur dans un réservoir). Si on enlève une portion!
de liquide b) et on laisse du vide, l'eau se précipite occuper la place!
libre... ! On doit en conclure qu'il existe à chaque point de la surface!
de la cavité une force F (normale à la surface) qui va accélérer!
l'eau dans la cavité.!
Dans a) F était en équilibre avec la réaction du fluide dans la cavité. !
1m!a)!b)!

5!
Pression .2!
La Pression moyenne exercée sur la surface A sur laquelle!
s'exerce la force totale Ftot est donnée par:!
€
P=1
A
F•ˆ
n
n!
Ftot!
^!
unité Pascal 1 Pa = 1 Nm-2!
Pression de l'atmosphère!
= 1 atm = 1,013 105 Pa!
= 1.013 bar!
= 760 mm Hg = 760 torr!
Instrument type: le baromètre de Torricelli!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%