4e – 7 – Interpréter les réactions chimiques – Support élève

SUPPORT ÉLÈVE
Cours et supports de M.Richter
!MAIN MENU
7.1. Masse et réaction chimique
Activité
Expérience :
On introduit dans un flacon de l’eau acidifié et on pose un morceau de
craie à côté. L’ensemble est pesé et on introduit ensuite le morceau de
craie dans le flacon. La pesée est à nouveau effectuée en fin de réaction.
On remarque que la craie à été consommée au cours de l’expérience. Un examen des
produits de la réaction montre qu’il y a eu formation de dioxyde de carbone : il y a eu une
réaction chimique.
4e – 7 – Interpréter les
réactions chimiques

On remarque également que la masse n’a pas variée au cours de la réaction chimique :
Au cours d’une réaction chimique, la masse totale des composants est conservé : la masse
des réactifs est égale à la masse des produits formés.
Ceci ne peut s’expliquer que par la conservation de la matière, or les molécules ne sont pas
conservées puisqu’il y a formation de nouveaux corps. les molécules sont donc constituées
de particules plus petites : les atomes.
7.2. Atomes et molécules
Dimension des atomes
Les molécules sont constituées d’atomes. Il existe 92 atomes naturels et environ 15 atomes
DIAPOSITIVE 1 SUR 11

crées par l’homme {montrer la classification périodique des éléments}
Les atomes sont très petits et peuvent êtres représentés par des sphères qui sont
assemblées pour constituer les molécules. Le rayon des atomes est de l’ordre de 100
picomètres (10 m). Ces sphères servent à constituer des représentations de molécules
appellées modèles moléculaires.
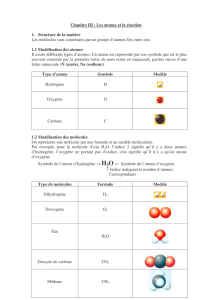
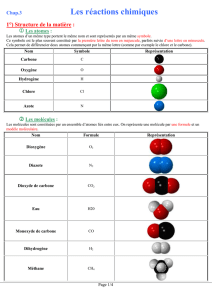
Symboles des atomes
Tous les atomes semblables ont le même nom et sont représentés par un symbole.
La première lettre de ce symbole est une majuscule (souvent la première lettre du nom
français).
Une seconde lettre est parfois nécessaire, elle s’écrit alors en minuscule.
Hydrogène : H – Carbone : C – Azote : N – Oxygène : O
2
10
18
36
9
17
35
53 54
86
84
83
82
80
8
16
34
52
85
7
15
33
51
6
14
32
50
5
13
31
49
81
30
48
29
47
79
28
46
27
78
45
26
44
76 77
25
43
24
42
74 75
23
41
73
72
40
22
21
39
89
57
4
12
20
38
56
88
1
1
19
37
55
87
1
3
Yb Lu
Lw
Md
Fm
Es
Bk
Tm
No
Er
Ho
Dy
Cf
Tb
Gd
Cm
Eu
Am
Sm
Pm
Np Pu
Nd
Pr
Pa U
Ce
Th
Ac
La
He
Ne
Ar
Kr
F
Cl
Br
IXe
Rn
Po
Bi
Pb
Hg
O
S
Se
T
e
At
N
P
As
Sb
C
Si
Ge
Sn
B
Al
Ga
In
T
l
Zn
Cd
Cu
Ag
Au
Ni
Pd
Co
Pt
Rh
Fe
Ru
Os Ir
Mn
Tc
Cr
Mo
WRe
V
Nb
T
a
Hf
Zr
Ti
Sc
Y
Ac
La
Be
Mg
Ca
Sr
Ba
Ra
Na
K
Rb
Cs
Fr
H
Li
18
17
16
15
14
13
12
11
8
6
37
45
2
1910
Actinium
Radium
Francium
Hélium
Néon
Argon
Krypton
Fluore
Chlore
Brome
Iode
Xenon
Radon
Polonium
Bismuth
Plomb
Mercure
Oxygène
Soufre
Sélénium
T
ellure
Astate
Azote
Phosphore
Arsenic
Antimoine
Carbone
Silicium
Germanium
Etain
in
Bore
Aluminum
Gallium
Indium
Thallium
Zinc
Cadmium
Cuivre
Argent
Or
Nickel
Palladium
Cobalt
Platine
Rhodium
Fer
Ruthénium
Osmium
Iridium
Manganèse
Chrome
Molybdène
Tungstène
Rhénium
V
anadium
Niobium
T
antale
Hafnium
Zirconium Titane
Scandium
Yttrium
Lanthane
Beryllium
Magnesium
Calcium
Strontium
Baryum
Sodium
Potassium
Rubidium
Césium
Hydrogène
Lithium
T
echnétium
1,0
1
H
Hydrogène
1,0
6,9
Masse molaire atomique
en g.mol-1
Symbole
Numéro atomique
(nombre de charge)
9,0
23,0 24,3
39,1 40,1
85,5 87,6
132,9 137,3
223 226,1 227
Etat du corps simple correspondant aux éléments :
Noir = Solide ; Rouge = Gazeux ; = Liquide.Vert
Les éléments en rose sont obtenus par synthèse
Fond : = Métaux vrais ; = Non métaux ; = Semi-Conducteurs ; = Gaz noblesVert Rose Bleu Jaune
Cadre rouge = élément rare
45,0 47,9 50,9 52,0
88,9 91,2 92,9 95,9
138,9 178,5 180,9 183,9
54,9 55,8 58,9 58,7 63,5
98,8 101,1 102,9 106,4 107,9
186,2 190,2 192,2 195,1 197,0
27,0 28,1 31,0 32,1
65,4 69,7 72,6 74,9 79,0
112,4 114,8 118,7 121,8 127,6
200,6 204,4 207,2 209,0 209
4,0
10,8 12,0 14,0 16,0 19,0 20,2
35,5 39,9
© 1994-2007 (Révision 22-09-2007), Jean-Luc RICHTER
79,9 83,8
126,9 131,3
210 222
Rf Db Sg Bh
Rutherfordium
Dubnium
Hs Mt
Seaborgium
Bohrium
Hassium
Meitnerium
104 105 106 107 108 109
261 262 266 264 269 268
57 58 59 60 61 62 63 64
89 90 91 92 93 94 95 96
138,9 140,1 140,9 144,2 145 150,0 152,0 157,3
227 232,0 231,0 238,0 237 242 243 247
Lanthane
Cérium
Praséodyme
Néodyme
Prométhéum
Samarium
Europium
Gadolinium
Actinium
Thorium
Protactinium
Uranium
Neptunium
Plutonium
Américium
97 98 99 100 101 102 103
65 66 67 68 69 70 71
158,9 162,5 164,9 167,3 168,9 173,0 175,0
249 251 254 253 256 254 257
Terbium
Dysprosium
Holmium
Erbium
Thulium
Ytterbium
Lutétium
Curium
Berkélium
Californium
Einsteinium
Fermium
Mendélévium
Nobélium
Lawrencium
Ds
Darmstadtium
110
281
Rg
Roentgenium
111
280
-12

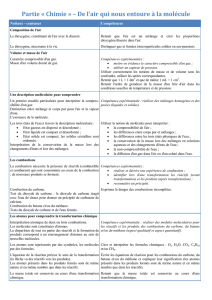
Molécules de quelques corps purs
Les symboles des atomes sont assemblés pour former les formules chimiques des
molécules.
On classe ces molécules en deux grandes familles :
Corps purs simples
Les corps purs simples sont constitués d’atomes tous identiques.
Exemples : Hélium, dioxygène, Ozone, Fullerène.
L’ozone possède trois atomes d’oxygène O , elle permet le maintient de la vie sur terre en
absorbant une grosse partie des rayons ultraviolets de la haute atmosphère, mais l’ozone
est en lui-même un gaz toxique pour l’homme.
Corps composés
Les molécules des corps composés sont constituées à partir d’atomes de types différents.
Exemples : eau, dioxyde de carbone, butane, méthane.
{donner les formules chimiques et expliquer les symboles et indices}
7.3. atomes et réaction chimique
Définition :
Une réaction chimique est un processus par lequel certaines espèces chimiques se
transforment en d’autres espèces chimiques, a la suite du réarrangement des atomes.
Loi de conservation des atomes :
Au cours d’une réaction chimique, les atomes des espèces chimiques qui disparaissent
3

(réactifs) se retrouvent dans les espèces chimiques qui se forment (produits).
Exemple :
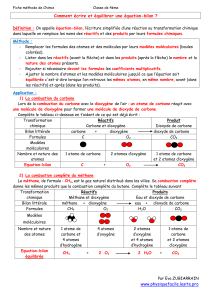
La combustion du carbone est une réaction chimique. Au cours de cette combustion, le
carbone et le dioxygène disparaissent alors qu’un nouveau corps apparaît : le dioxyde de
carbone.
Remarque
: Une combustion est une réaction chimique qui nécessite la présence d’un
combustible (carbone) et d’un comburant (dioxygène) placé dans des conditions favorables.
L’équation-Bilan
L’équation-bilan traduit le bilan de la réaction chimique en utilisant les formules des
réactifs et des produits.
Les réactifs sont séparés des produits par une flèche. L’équation-bilan respecte la loi de
conservation des atomes.
Page 1 of 1
Equation-Bilan de réaction chimique
Lʼéquation-bilan traduit le BILAN CHIMIQUE dʼune réaction, Elle sʼécrit avec les
formules moléculaires.
Pour écrire lʼéquation-bilan on note les formules des réactifs et des produits de la réaction,
séparés par une flèche.
Conservation de la matière
La matière se conserve. Donc les atomes se conservent.
Il y a donc autant dʼatomes de chaque sorte avant et après la réaction.
Pour traduire la conservation de la matière il faut parfois équilibrer lʼéquation-bilan.
Equilibrer une équation-bilan consiste à placer des coefficients entiers devant les formules
chimiques afin de traduire le respect de la loi de conservation de la matière.
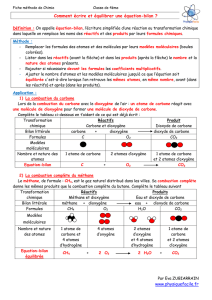
Exemple 1
Combustion du Carbone
• Etape 1 : Faire la liste des réactifs et des produits
• Réactifs : Carbone, Dioxygène
• Produit : Dioxyde de carbone
• Etape 2 : Ecrire lʼéquation-bilan en “français”
Carbone + Doxygène → Dioxyde de carbone
• Etape 3 : Remplacer les noms par les formules
C + O2 → CO2
• Etape 4 : Vérifier la conservation des atomes
Réactifs : 1 atome de carbone, 2 atomes dʼoxygène
Produits : 1 atome de carbone, 2 atomes dʼoxygène
Réaction équilibrée
 6
6
 7
7
 8
8
1
/
8
100%