Sujet 1 : Spectroscopie

Page 1 sur 3
Corrigé
Sujet 1 : Spectroscopie
Réponses
C
A
R
E
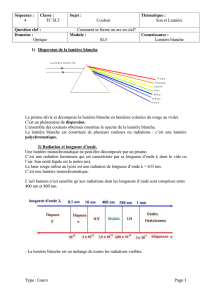
1. Le texte retrace l’expérience
historique de Isaac Newton au
XVIIième siècle (1666) dans sa
demeure personnelle où il mît en
évidence que la lumière du soleil
était en réalité une somme de
radiations visibles de longueur
d’onde allant du violet à 400 nm
jusqu’au rouge à 800 nm. Il réussit à
l’aide de deux prismes à isoler une des radiations.
* *
* *
* *
* *
* *
2. Un spectroscope permet d’obtenir le spectre en longueur d’onde des radiations
contenues dans un faisceau de lumière incident. Il contient un objet réfractant comme
un prisme (ou diffractant comme un réseau).
* *
* *
* *
3. Titre : Evolution de la longueur d’onde (en nm) en fonction de la distance L (en
mm).
*
*
4. Ce graphe est en fait une courbe d’étalonnage établie à partir d’un élément de
référence comme l’Argon. On a tracé la courbe pour différentes longueurs d’onde
des radiations émises par le gaz source de lumière en fonction de la distance mesurée
à partir d’une origine.
*
*
5. Ce graphe montre que la longueur d’onde est une fonction affine du type y = a.x +
b de la distance mesurée. C’est à partir de ce graphe que l’on pourra relier la distance
mesurée L sur un spectre étudiée dans des conditions similaires en fonction de la
longueur d’onde .
*
*
*
6. Le tableau du document 3 montre qu’il y a deux lignes à compléter. La première est
celle des longueurs d’onde et la seconde celle des entités chimiques.
Pour le premier cas, il suffit pour chaque distance de lire la coordonnée
correspondante sur le graphe précédent et encore mieux d’utiliser l’équation inscrite à
la place du titre.
Pour le second, il suffit de chercher l’entité qui possède la longueur d’onde la plus
* *
* *
* *

Page 2 sur 3
proche.
Par exemple, pour L = 6 mm de la raie n°2. En utilisant directement l’équation, on
trouve : = 0,9732*6 + 390,65 = 396,49 nm. Cette valeur correspondrait à celle de
l’ion calcium (396,8 nm).
Tableau de réponses
7. Le document 4 montre au-dessus le spectre d’absorption de raies du Mercure, raies
noires sur fond coloré. Le spectre au-dessous est celui d’émission de raies du même
élément, raies colorées sur fond noir.
* *
Sujet 2 : La table de classification périodique des éléments
Réponses
C
A
R
E
1. Le tableau de classification périodique des éléments a été initié par Dimitri
Mendeleiev au XIXième siècle (1870).
* *
*
2. Une ligne correspond aux éléments qui remplissent la couche électronique externe,
soient 2 éléments pour la couche K, 8 pour la couche L, etc…
*
*
3. Les colonnes sont associées aux éléments d’une même famille, qui ont donc des
propriétés semblables avec une couche externe possédant le même nombre
d’électrons.
*
*
4. Dans le tableau, les éléments sont rangés par ordre croissant du numéro atomique.
* *
* *
*
5. Structure électronique de l’Aluminium, qui d’après le tableau possède 13 protons
donc 13 électrons puisqu’il est neutre par propriété de l’atome : (K)2(L)8(M)3.
*
*

Page 3 sur 3
6. L’atome d’Aluminium doit respecter la règle de l’octet, il doit former une couche
externe à 8 électrons pour devenir un ion stable. Dans notre cas, il lui est préférable de
céder 3 électrons pour ressembler au gaz noble le plus proche de lui dans la
classification. L’ion aluminium s’écrit donc : Al3+.
*
*
*
7. Pour l’élément calcium, la réponse est similaire à la précédente, il doit ressembler
au gaz noble le plus proche de lui, soit l’Argon. Il lui faut rétrograder de 2 cases pour
arriver à celle de l’Argon, il perd donc 2 électrons, soit l’ion calcium Ca2+.
* *
*
8. Quel élément chimique porte une charge dans son noyau Q = 1,44.10-18 Coulomb ?
On rappelle que la charge élémentaire vaut e = 1,6.10-19 C. Logiquement, on peut
écrire la relation : Q = Z.e d’où l’on tire le numéro atomique Z =
=
= 9.
Il s’agit donc du fluor, Z =9.
*
*
*
1
/
3
100%