Program Description - Infoterre
publicité

MINISTÈRE DE L'INDUSTRIE
BUREAU DE RECHERCHES GÉOLOGIQUES ET MINIÈRES
SERVICE G É O L O G I Q U E NATIONAL
B.P. 6009 - 45060 Orléans Cedex - Tél.: (38) 63.80.01
APPLICATION DES GÉOTHERMOMÈTRES
ET GÉOBAROMÈTRES MINÉRAUX MAGMATIQUES
A LA RECHERCHE GÉOTHERMIQUE
par
Nicole METRICH* et Jacques VARET*
Département géothermie
B.P. 6009 - 45060 Orléans Cedex - Tél.: (38) 63.80.01
*
Université de Paris Sud - Orsay
** B . R . G . M . - Département Géothermie
80 SGN 474 GTH
Réalisation : Département des Arts Graphiques
Juillet 1 9 8 0
RESUME
L'étude des formations volcaniques, sur le terrain et en
laboratoire, est une technique essentielle en prospection géothermique
haute énergie. Cette discipline scientifique intervient en particulier aux stades initiaux de la reconnaissance générale pour la sélection
de sites recelant des stocks magmatiques à faible profondeur dans la
voûte terrestre et susceptibles de constituer une source de chaleur
située à profondeur suffisamment faible dans la voûte pour surchauffer
un réservoir hydrothermal.
Parmi les méthodes volcanologiques et pétrologiques, l'étude
des équilibres entre couples de phénocristaux et entre phénocristaux
et liquides permet dans quelques cas de préciser l'histoire thermique
des magmas et de déterminer en conséquence température, pression totale
et pression de fluide régnant lors de la cristalisation partielle de
ces magmas en profondeur.
Il est possible de déterminer avec une certaine approximation
la profondeur et la température de la source de chaleur en utilisant
ces géothermcmètres et géobarcmetres minéraux.
Un couple de minéraux suivants peuvent être utilisés :
- Oxydes de Fe et Ti (Buddignton - Lindsley, Powell-Powell)
- Equilibre plagioclase-liquide (Kudo-Weill, Mathez, SunWilliams, Drake-Weill, Drake)
- Equilibre feldspath alcalin - plagioclase (Stormer, PowellPowell)
- Equilibre olivine-liquide (Reeder - Emslie, Roeder, Leeman
Scheidegger, Leeman, Hart-Davis)
- Equilibre olivine - clinopyroxène, liquide (Hakli-Wright,
Hakli, Glitsh-Allègre)
- Equilibre orthopyroxène - clinopyroxène (Wood-Barro, Wells,
Sun-Williams, Saxena-Nehru, Ross-Huebner)
- Equilibre clinopyroxène olivine (Powell-Powell)
- Géobaromètres de Sun-Williams, Drake, et basés sur les
équilibres de la biotite et de l'amphibole
Les programmes de calcul correspondant à chacun de ces gëothermometres et géobaromètres a été établi pour le mini-ordinateur H.P.97.
Les possibilités d'utilisation de ces géothermomètres et géobaromètres pour déterminer température et profondeur des chambres magmatiques sont discutées. Quelques exemples d'applications à des champs
géothermiques potentiels sont indiqués.
Cette étude a été réalisée sur fonds propres dans le cadre
du programme géothermie.
TABLE DES MATTERES
Pages
I - INTRODUCTION
1.1. - OBJET DU PRESENT RAPPORT
1
1.2. - EQUILIBRE DE PHASES
2
1.3. - EQUILIBRES PETROGRAPHIQUES
4
1.4. - EQUILIBRES MINERAUX CONSIDERES
5
II - EQUILIBRES MINERAUX CONNUS DANS LA Ll'ITERATURE
11.1. - EQUILIBRE OXYDES Fe-Ti
7
7
11.1.1. - Géothermomètre de Buddington et Lindsley
7
11.1.2. - Géothermomètre de Powell et Powell
9
11.2. - EQUILIBRE PLAGIOCLASE - LIQUIDE
10
11.2.1. - Géothermomètre de Kudo-Weill
10
11.2.2. - Géothermomètre de Mathez
12
11.2.3. - Géothermomètre de Sun-Williams et Sun
13
11.2.4. - Géothermomètre de Drake et Weill
14
11.2.5. - Géothermomètre de Drake
14
11.2.6. - Application de ces géothermomètres
16
11.3. - EQUILIBRE PLAGIOCLASE - FELDSPATH ALCALIN
19
11.3.1. - Géothermomètre de Stonner
19
11.3.2. - Géothermomètre de Powell et Powell
20
11.4. - EQUILIBRE OLIVINE - LIQUIDE
21
11.4.1. - Géothermomètre de Roeder et Emslie
21
11.4.2. - Géothermomètre de Roeder
21
11.4.3. - Géothermomètre de Leeman et Scheidegfer
22
11.4.4. - Géothermomètre de Leeman
23
11.4.5. - Géothermomètre de Hart et Davis
23
11.4.6. - Comparaison entre les températures
obtenues à partir des différents géothermomètres basés sur l'équilibre
olivine-liquide
24
11.5. - EQUILIBRE OLIVINE - CLINOPYROXENE LIQUIDE
27
11.5.1. - Géothermomètre de Habili et Wright
27
11.5.2. - Application
27
11.5.3. - Géothermomètre de Glitsch et Allègre
28
11.6. - EQUILIBRE ORTHOPYROXENE - CLINOPYROXENE
11.6.1. - Géothermomètre de Wood
et Banno
30
30
11.6.2. - Géothennomètre de Wells
31
11.6.3. - Géothermomètre de Sun, Williams et Sun
31
11.6.4. - Géothermomètre de Saxena et Nehru
31
11.6.5. - Géothermomètre de Ross et Huebner
33
11.6.6. - Application de ces différents géothermomètres
33
11.7. - EQUILIBRE OLIVINE - CLINOPYROXENE
II.7.1. - Géothermomètre de Powell et Powell
11.8. - LES GEOBAROMETRES
35
35
36
11.8.1. - Géobaromètre de Sun, Williams et Sun
36
11.8.2. - Géobaromètre de Drake
36
11.8.3. - Application de ces géobaromètres
37
III - AUTRES METHODES : GEOTHERMOMETRIE EXPERIMENTALE
39
111.1. - Pétrologie expérimentale
39
111.2. - La thermomètrie optique
39
IV - PROGRAMMES ETABLIS POUR LA H.P. 97
41
IV.1. - GEOTHERMOMETRES
41
IV.2. - GEOBAROMETRES
42
V - CONCLUSION
BIBLIOGRAPHIE
ANNEXE : Programes de calcul correspondant à chacun des geotherncmetres
et géobaroinètres
43
LISTE DES FIGURES
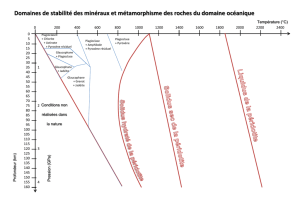
Coupe simplifiée d'un champ géothermique
1 bis:
Géo-thermomètre de Buddington et Lindsley
Relation à l'équilibre entre les solutions solides ilménite-hématite,
magnétite-ulvospinelle, la température et la fugacité d'oxygène.
2
Variation du rapport yKb/yïin en fonction du % An du plagioclase.
Comparaison entre les données d'Orville (1972) et celles de
Mathez.
:
Diagramme température P H20 de Kudo^Weill
Géothermomètre de Ross et Huebner
Températures de coexistence de trois phases - pigeonite, augite,
orthopyroxène - pour différentes compositions de ceux-ci.
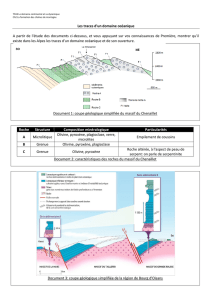
Volcan
\C
laves renfermant des phénocristaux
stabilisés au sein de la chambre
magmatique
Hot spring
"Feeble"
warm spring
• •;
• •
•
•
•
••
A:?/
\
•» »«
—N
5"* • • •
- —*/
CHAMBRE MAGtlATIQüE
:::i:':r.
(zone de convection maqmaf,-ï<ïi^)-
/
^
' \
Fig.l : Coupe simplifiée d'un champ géothermique : l'étude de la minéralogie des laves permet de préciser les conditions
physiques prévalant dans la chambre magmatique et donc de préciser la profondeur de la source de chaleur du champ
géothermique.
\
- 1 -
I
Introduction
I.I Objet du présent rapport
La volcanologie et la pétrologie sont deux spécialités
scientifiques de grand intérêt en prospection géothermique. La formation
d'un champ géothermique de haute énergie repose en effet sur la présence
dans la croûte superficielle, soit à quelques kilomètres de profondeur,
d'un stock magmatique constituant la source de chaleur du système. Cette
chambre magmatique doit être vaste, jeune et avoir fonctionné pendant
un temps suffisant pour réchauffer le réservoir géothermal qui constitue
l'objectif industriel (fig. 1).
La présence d'une chambre magmatique à faible profondeur est
le plus souvent accompagnée d'indices de surface constitués de formations volcaniques : coulées, domes, pyroclastites.
L'étude de l'âge et de la nature des produits volcaniques"
seule permet d'approcher de manière économique les caractéristiques de• '
la source de chaleur : température et profondeur.
Une approximation sur la profondeur et la température de la
source de chaleur peut être obtenue à partir de la simple nature des
produits émis. On s'accorde généralement à penser - dans les milieux
de la prospection géothermique - que la présence de matériels acides
(rhyolite, rhyodacite ou trachyte) traduit une position superficielle '
de la source de chaleur et constitue donc un bon indice de champ géothermique.
Mais une approche plus rigoureuse est possible, basée sur les
équilibres physico-chimiques entre minéraux et entre minéraux et liquides.
Pour une composition chimique donnée, ces équilibres se déplacent selon
les variations de pression et de température. La composition chimique des
phases minérales en présence nous informe donc sur la température et la
pression auxquelles l'équilibre a été atteint en profondeur. Il est donc ^
a priori possible d'appliquer l'utilisation de tels équilibres à la dé-:
termination de la température et de la profondeur de la source de chaleur.
- 2 -
Bien entendu, l'application des géothermomètres et géobaromètres minéraux ne peut être envisagée qu'après une étude approfondie
sur le terrain avec cartographie et échantillonnage détaillés, suivi
d'une étude pétrographigue et minéralogique en laboratoire précisant
la nature des différents produits magmatiques mis en place dans la zone
d'étude. C'est sur la base de l'étude minéralogique et pétrologique des
minéraux sélectionnés c a m e représentatifs de l'évolution magmatique que
pourra être évalué l'intérêt d'une étude des géothentonetres et géobaromètres.
L'objet de ce rapport est tout d'abord de collecter les données
concernant les géothermomètres et les géobaromètres s'appliquant aux
minéraux haute température des laves.
Ces données seront ensuite exposées, testées puis critiquées
de façon à faire ressortir clairement les limites d'application de ces
méthodes.
Les programmes de calcul correspondant ont établis pour les
micro-ordinateurs de type HP 97.
Le présent rapport se limite aux minéraux magmatiques. Sont
donc exclu les minéraux d'altération hydrothermaux caractérisant les
réservoirs géothermiques ou leur couverture. L'étude de leur application
en géothermie fera l'objet d'un autre rapport.
1.2 Equilibres de phases
Les phases solides considérées font intervenir les solutions
solides (oxydes, feldspaths, olivines, pyroxenes) seules ou en équilibre avec un liquide. De nombreux travaux expérimentaux ont portés sur
l'étude de ces systèmes. Ils font apparaître l'existence de deux types
de sites accessibles aux éléments (Fe , Ti, Na, K, Ca , Mg), reconnus par
études cristallographiques qui permettent généralement de leur appliquer des modèles sirrples, dits "idéaux à 2 sites" permettant de déterminer les variations des terreurs en ces éléments entre couples de
solutions solides ou couples solution solides - liquides
en fonction
de paramètres physiques tels la température, la précision ou la fugacité
de l'oxygène.
- 3 -
On représente généralement l'énergie libre molaire d'une
solution binaire de deux constituants A et B sous la forme d'une
épuration (J. Roux, 1979) :
G = Xy° A
+ Yy° B
+ ET (X In X + Y In Y) + G ^
où X et Y désignent les fractions molaires de A et B respectivement
(i.e. A + B = 1). On y distingue :
- un terme qui est une caribinaison linéaire des énergies libres
molaires des pôles A et B.
- un terme lié à l'entropie de configuration d'un mélange idéal .
des deux constituants
- enfin un terme correctif G2*
qui représente l'écart entre
la solution réelle et une solution idéale des deux constituants. Ce
terme est nul pour les solutions idéales et de degré 1 pour les modèles .
idéaux à 2 sites. On obtient dans ce dernier cas les relations suivantes
&
= y°A
- y°B
A
dx
=
o
y°
- y
A
= p°A
tí
o
R
+
HP in S
Yl
+
fe
m
_, _ , , XZ
b
+ ET In — - YZ m
B
- y°B
+*rm5
ym
1
__
y11
Z
et pour les potentiels chimiques :
= y°A
+ET1HXJ1 X n
=
+
y
B
__ . „ m „ n
ET1HY1 Y z
•••/•••
- 4 -
1.3. Equilibres pétrographiques
L'application de telles équations à des minéraux naturels
suppose qu'un certain nombre de conditions soient satisfaites. En
particulier que les phases solides considérées sont en équilibre entre
elles et en équilibre avec le liquide dans lequel elles se trouvent.
Ces conditions d'équilibre sont plus facilement vérifiées
dans des roches volcaniques à mésostase vitreuse et comportant des
phénocristaux de faible dimension et en faible abondance (moins de
5 %).
La composition du liquide est alors facile à déterminer :
une analyse de verre par microsonde, ou de la roche totale suffit pour
une bonne détermination.
Lorsque la roche est microcristalline, microgrenue ou grenue,
et que les phases phénocristallines sont en plus grande abondance, il
est plus difficile d'établir avec certitude ou précision la composition
du liquide. L'étude des phases minérales présentes dans la roche permet
alors d'étudier l'histoire thermique de celle-ci, mais éventuellement
limite les connaissances à l'histoire la plus tardive (syn et post
eruptive) et ne permet pas toujours d'approcher les conditions régnant
dans la chambre magmatique.
Les phénocristaux, à moins qu'ils ne soient contigus et
montrent des évidences petrographiques de syncristallisation, ne
sont pas toujours garantis appartenir à la même période de cristallisation, le magma ayant pu subir plusieurs phases de cristallisation
partielle intra-tellurique, voire même des phénomènes de contamination.
Il importe donc d'examiner avec précision les phases coexistantes afin
de déterminer si elles appartiennent bien à la même période de l'histoire du magma. Seules ces dernières sont susceptibles de fournir une
application valable des géothermomëtres et géobaromètres.
- 5 -
1.4. Equilibres minéraux considérés
Les principaux minéraux caractérisant les roches volcaniques
sont les feldspaths, les pyroxenes, l'olivine, le quartz, ces oxydes
de fer et de titane et les feldspathoïdes.
Tous ces minéraux peuvent être utilisés coirme géothermomètres
ou géobaromètres.
Equilibre oxydes
Géothermanêtre de Buddington et Lindsley
Géothermomètre de Powell et Powell
Equilibre plagioclase-liquide
Géothermomètre de Kudo-Weill
Géothermcmètre de Mathez
Géothermomètre de Sun-Williams et Sun
Géothermonètre de Drake et Weill
Géothermanêtre de Drake
Applications
Equilibre feldspath alcalin-plagioclase
Géothermomètre de Stormer
Géothermomètre de Powell et Powell
Equilibre olivine-liquide
Géothermomètre de Poeder et Emslie
Géothermomètre de Roeder
Géothermanêtre de Leeman et Scheidegger
Géothermomètre de Leeman
Géothermomètre de Hart et Davis
Applications
•
•
•
/
•
•
•
- 6 -
Equilibre olivine-clinopyroxène-liquide
Gëothermomètre de Hakli et Wright
Géothermomètre de Hakli
Gébthermomètre de Glitsch et Allègre
Equilibre orthqpyroxène-clinopyroxène
Géotherniatiètre de Wood et Banno
Géothentianëtre de Wells
Géothernanêtre de Sun-Williams et Sun
Géothenncmètre de Saxena-Nehru
Géotherniatiètre de Roos et Huebner
Equilibre clinopyroxène-olivine
Géotiiermomètre de Powell et Powell
Géobaromètres
Géobaromètre de Stm-Williams et Sun
Géothermomètre de Drake
Géothermanètres basés sur les équilibres
biotite-sanidine-magnêtite
orthopyix3xène-cnj!Tnângtonite--quartz
-
7 -
II - EQUILIBRES MINERAUX CONNUS DANS IA LITTERATURE
2.1
Equilibre oxydes Fe-Ti
2.1.1 Géothermomètre de Buddington et Lindsley (1964)
Les travaux expérimentaux de Buddington et Lindsley
dans le système FeO-Fe2O3-TiO2 ont mis en évidence, et de façon
précise la relation à l'équilibre entre les solutions solides
ilménite-hématite, magnetite-ulvospinelle, la température et
la fugacité d'oxygène (fO2) (fig. I bis).
Leurs données sont appliquées à. un large domaine de température
et de fO2.
L'utilisation de ce géothermomètre nécessite le calcul
du % d'ulvospinelle (% usp) dans la magnetite et du % d'hématite
(hem) dans l'ilmenite.
Deux méthodes ont été proposées :
- celle de Carmichael (1967) :
- calcul du % d'ulvospinelle (Fe2TiO4) dans la magnetite
pour cela il faut :
-a
former Mn2TiO4 et Mg2TiO4
d'où
Ti 1 = Ti - (Mn+Mg/2)
-b
calculer FeAl2O4 et FeCr204
d'où
Fe' = Fe -(Al+Cr/2)
-c
Former Fe2TiO4
d'où " .Fe" = Fe 1 - 2Ti'
-d
calculer le fer restant en Fe3O4
'
Fe2TiO4 + Mn2TiO4 + Mg2TiO4
d'où % ups
Fe304 + Fe2TiO4 + Mn2TiO4 + Mg2TiO4
- calcul du % d'hématite dans l'ilraenite :
pour cela il faut :
-a
former MnTiO3 et MgTiO3
d'où
Ti 1 = Ti - (Mn+Mg)
-b
calculer Al2FeO4.et Cr2FeO4
d'où
Fe 1 = Fe - (Al+Cr/2)
-c
former FeTiO3
d'où Fe" = Fe 1 - Ti'
_d
calculer le Fe restant en Fe2O3
Fe2O3 + MnTiO3 + MgTiO3
d'où
% ihem =• Fe2O3 + MnTiO3 + MgTiO3 + FeTiO3
- 8 -
- celle d'Anderson (1968)
- calcul du % d'ulvospinelle dans la magnetite
pour cela il faut :
-a
former MgO.7FeO.3A12O4
-b
calculer le Mg restant sous forme de Mg2TiO4
-c
former comme précédemment : Mn2TiO4
Fe2TiO4
Fe3O4
d'où % usp1
=
Fe2TiO4 / Fe2TiO4 + Fe3O4
- calcul du % d'hématite dans l'ilmenite :
pour cela il faut :
-a
former MgO.7FeO.3Al2O4
-b
puis MgTiO3, MnTiO3, FeTiO3 et Fe2O3
d'où % hem1
=
Fe2O3 / Fe2O3 + FeTiO3
Des travaux plus récents (Spaidel 1970, Neumann 1974)
ont montré l'influence de MgO et MnO et par extrapolation celles
de A12O3 et Cr2O3 sur les équilibres considérés.
C'est pourquoi H. Bizouard (thèse à paraitre) a introduit dans
la formule de Carmichael la mole (Al,Cr )2FeO4.
Ses résultats sont très proches de ceux de Anderson.
De toute façon, Maury (1976) montre que l'écart de température
engendré par les différentes méthodes de calcul du % d'ulvospinelle
et du % d'hématite est de 1O°C.
Exemple pour un même couple ilménite-magnetite :
usp' = 64.6 %
usp = 66.9 %
usp" = 64.6 %
hem' = 3.3 %
hem = 3.1 %
hem" = 3.0 %
(Anderson)
(Carmichael)
(Bizouard)
- 9 -
II faut surtout noter que l'erreur faite sur l'estimation
de Fe3+ dans les oxydes est très largement.supérieure.
Dans l'exemple précèdent l'erreur analytique faite sur les différents
éléments engendre une erreur de : 8% sur Fe2O3 et de 4% sur
le % d'ulvospinelle,
d'où la température ' est de 87O°C - 40°C et la fO2 de -14.2 ± 0 . 7
Ce géothermomètre fondé sur l'équilibre oxydes Fe-Ti est le plus
utilisé par les pétrographes et très souvent pris comme référence
pour les autres géothermomètres.
Ewart et Al (1975) par exemple constate un bon accord entre les
températures estimées par cette méthode et les résultats obtenus
à partir du rapport O 1 ^ / 0 1 8 (7 6O°C).
2.1.2.Géothermomètre de Powell et Powell (1977)
Ces auteurs, à partir des données de Buddington et
Lindsley et celles de Carmichael, formulent de façon indépendante
et sous forme d'équations un géothermomètre et un géobaromètre
fondé sur l'équilibre ilménite-magnetite :
d'où
Ln Kd = -3155 / T + 4 . 5 9
Kd = Xulv . Xhem / Xmgt. Xilm
et
o
fi
6
Log ao¿ - Lnux^ t .xi¿iv ^ulv' * l3Silv#
lO 7
hem ' ^mt« x x l m ^
- A QA
Ces équations ne peuvent s'appliquer que dans le cas de solutions
binaires idéales Fe2TiO4-Fe3O4 / FeTiO3-Fe2O3.
Ces équations sont très rarement utilisées, cependant si nous
les appliquons à l'exemple précédent la température obtenue
avec :
usp 1 = 64.6 et hem' = 3 . 3
est de 834°C
et fO2 = -14.92
Ces valeurs tombent dans l'intervalle d'erreur calculé dans le
paragraphe précédent.
- 10 -
2.2
Equilibre plagioclase-liquide
2.2.1 Géo-thermomètre de Kudo-Weill (1970)
Ce géothermomstre se base sur 1'activité partielle
d'albite (Ab) et d'anorthite (An) dans le plagioclase et celles
des éléments Si, Na, Al, Ca dans le liquide coexistant .
La réaction invoquée est la suivante :
(NaSiO2
5 )AlSi 2 0 5 5 )
+
plagioclase
liquide
O5
+
5
liquide
(CaAlO2<5)AlSi2O5
plagioclase
Si la solution solide albite, anorthite est considérée comme
une solution idéale à haute température, dans les conditions
d'équilibre la relation entre la composition dû liquide, celle
du plagioclase coexistant et la température est la suivante :
y (T)
=
Ln X/tr +
C
*/
T
(1)
où
X = XNa . XSi / XCa . XAl
o = X Ab / X An
$' = X Ca + X Al - X Si - X Na
et X Na + X Ca + X Al * X Si = 1
A partir de cette équation (1) il est alors possible de
calculer les coefficients de regression pour différentes composition.1
des couples plagioclase-liquide et différentes températures connues.
Les auteurs se sont basés sur :
- des roches naturelles de composition granitique, sans K20
pour des P H20 de 0.5 et 1 Kb et un intervalle de température
de 780 à 93O°C
- des systèmes expérimentaux (Bowen 1913, 1915; Prince 1943;
Yoder 1957) :
Ab-An, Ab-An-Di, Ab-An-Sp à sec
Ab-An, Ab-An-Or pour des P H20 de 5 Kb.
- l i -
lis obtiennent 4 équations en fonction de la
température de la forme :
T°K = 1/B ( Ln A/r
(Ln \£- + A ) 2 + 4 <£' C. B
+
dans laquelle A et B sont les coefficients de regression
dont les valeurs pour les différentes P H20 sont données
ci-dessous :
A
P H20
B
à sec
17.23
10.34
1O" 3
0.5 Kb
17.86
11;05
lo" 3
1 Kb
17.67
11.14
lo" 3
5 Kb
16.63
12.18
ÍO" 3
C est une constante calculée empiriquement. Elle résulte
de la moyenne de 39 valeurs C 1 , obtenue à partir de
1'équation suivante :
C
=
Ln
1 et 2 représentant 2couples plagioclase-liquide en équilibre
à la même température.
C = 1.29 1 0 4 quelque soit la température et la P H20.
Les températures obtenues à partir de ce.géothermomètre
sont testées par les auteurs sur différents types de roches
basaltes,tholeiites, trachytes, rhyolites, et comparées
aux températures obtenues à partir du géothermomètre de
Buddington soit à des températures expérimentales.
Cependant les températures calculées à partir des
équations ée Kudo-Weill pour des basaltes à olivines, des
trachybasaltes et de trachytes de la région du lac Rudolph
(Rift vallée est africain, Carmichael et Al 1971)
et pour des basaltes andesitiquès (Tongan Ewart 1974)
sont trop élevées pour les P H20 correspondantes.
- 12 -
Bryan (1975) donne une explication eventuelle à ce
phénomène. En effet, il montre une substitution du type
Ca(Fe/Mg)SißOg dans les plagioclases dont on ne tient pas compte
en général. Le % d'An dans le plagioclase est alors surestimé
et donc la température.
2.2.2 Géothermomètre de Mathez (1973)
Cet auteur en accord avec Carmichael.et Ewart,
juge les températures de Kudo-Weill trop élevées pour les roches
basaltiques compte tenu de la P H20.
Il se propose donc de modifier le géothermomètre
précédent
- en se basant sur les travaux d'Orville (1972) il considère
la solution solide albite-anorthite conme une solution non idéale
à haute température, et introduit un coefficient d'activité y
corrigeant l'écart à la linéanité de la solution Ab-An;
d'où
le terme
= XAb / XAn de Kudo-Weill
devient
= XAb.yAb /XAn . y An
Les valeurs de yAb/yAn en fonction du % d'An dans le plagioclase
(fig. 2) sont déterminées empiriquement à partir de 42 couples
roche (basaltes, andésites)-plagioclase et d'après l'équation :
y(T)
= Ln V a + 1.29 10 4 * / T
-connaissant les coefficients y il détermine de nouveaux
coefficients de regression A1 et B 1 d'où
T°K
= 1/B1
(Lny/j
+ A1 i
(LnVa
+ A 1 ) 2 + 4 c£>'C B'
Les différents valeurs de A1 et B' en fonction des P H20 sont
données dans le tableau ci-dessous :
A'
B'
à sec
19.01
11.76 1O~ 3
0.5 Kb
15.21
9.87 1O~ 3
1 Kb
15.76
9.60 1O"~3
- 13 -
Deux remarques s'imposent :
ç:) Mathez utilise sans justification la constante C (C= 1.2 9
de Kudo-Weill, alors que celle-ci a essentiellement été
calculée à partir de matériel acide.
y) Seuls les cofficients de regression A1 et B' correspondant
à 0 Kb de P H20 ont été déterminés à partir de roches naturelles
basaltiques et andésitiques.
Pour 0.5 Kb et 1 Kb , Mathez a recalculé les coefficients de
Kudo-Weill en fonction des coefficients d'activité y.
D'autre part Smith (1972) a montré l'idéalité de la solution solid«
Ab-An à haute température.
lCOl
Fig.2 Variation du
rapport yAb/yAn en
fonction du % An du
plagioclase. Comparaison
entre les données d'Orville(1972) et celles
de Mathez.
M
1
o-' "
ru» j
' ' EAÍf.L1 DAI/.
4
í
20
í
n.'í
2.2.3
Géothermomètre de Sun-Williams et Sun (1974)
Ces auteurs montrent sur des basaltes de rides océaniques
la corrélation linéaire entre le coefficient de partage du Sr
(Sr plagioclase/Sr liquide) et la température :
Log D S r
= A/T + B
Les coefficients de regression (A et B) calculés pour les basaltes
cités, pour un intervalle de température de 1140 à 119O°C,
et fO2 de lo""8 à 1O'"14, permettent d'écrire la relation suivante :
Log
=
6570 (± 300) /T - 4.30 (± 0„21) (1)
Etant donné l'extrême dépendance du coefficient de partage D g r
vis à vis de la composition chimique du liquide comme le montrent
ces auteurs, .cette équation ne peut s'appliquer que dans les
- 14 -
conditions citées ci-dessus.
Si l'on calcule lerreur faite sur la température en considérant
ATZT = A A/A + 4B/B
et sans tenir compte de l'erreur faite sur le coefficient de
partage :
AT/T = 9%
2.2.4 Géothermomètre de Drake et weill (1975)
Les auteurs déterminent empiriquement un géothermomètrre
à partir des coefficients de partage du Ba, du Sr, dñ Ca entre
plagioclase et le liquide coexistant.
La relation thermodynamique entre le coefficient de partage D
d'un élément et la température est du type :
Ln D = A / T°K + B
Les coefficients de regression (A et B) ont été calculés à
partir de roches naturelles (basaltes, trachytes, rhyolites et
dacites), pour un intervalle de température de 1150 à 1400°C
à pression atmosphérique.
Trois équations en découlent :
Pour le baryum
T°K = 11800 / Ln D + 8.85
Pour le calcium
T°K = 5.82 / Ln D + 3.32
Pour le strontium
T°K = 9050 / Ln D + 5.24
Ces équations sont testées pour la baryum et le strontium
sur des roches basaltiques et andésitiques.
2.2.5 Géothermomètre de Drake (1976)
Drake reconsidère 1'équilibre plagioclase-liquide
pour des conditions physico-chimiques différentes de celles
de KudOTWeill.
Les roches utilisées sont des basaltes et des rhyolites naturelleî
La composition des plagioclases associés varie de ÄJI32 à An89
et la température de 1095 à 1400°C/ à pression atmosphérique.
Cet auteur exprime l'équilibre plagioclase-liquide sous forme
de plusieurs réactions dans lesquelles le liquide est
- soit composé de molécules simples :
d'où :
CaO + 2AIO3/2
liquide
+
2 si0
2 «=* CaAl2Si2O8 (1)
plagioclase
- 15 -
ou
NaOi/2
+ AIO3/2
liquide
+ 3 S i 0 2 tz. NaAlSi3Os
plagioclase
..
- soit composé de molécules complexes :
d'où
CaAl2O4
+-2 SiO2 î==r C a A l 2 S i 2 O 8
liquide
plagioclase
+ 3 S i O 2 t=;
liquide
NaAlSÍ3O 8
plagioclase
(3)
ou
NaAlO2
(4)
Pour chaque équation l'auteur détermine la constante d'équilibre
K pour différentes températures et compositions du plagioclase
et du liquide.
Une bonne corrélation K, température est obtenue pour la
réaction 4.
d'où
T°K = 6100 / Ln (XAb/X 3 SiO 2 •
x
NaAlO2 (liq)) + 2.29
où
X NaAlO 2 = NaAlO 2 / KA102 + NaAl02 + C a A l 2 0 4 + SiO 2 + CaO
A partir des différents travaux expérimentaux ( Yoder 1957,
Piiwinski 1968, Lindsley 1969) Drake montre que cette constante
d'équilibre K4 est indépendante de la pression, si celle-ci
n'excède pas 10 Kb.
- 16 -
2.2.6 Application de ces géothermomètres.
6.1 Comparaison entre les températures calculées à partiE
de différents géothermomètres (Kudo-Weill, Mathez, Drake et
Weill, Drake) et celles obtenues soit à partir de la
thermométrie optique soit à partir d'autres méthodes;
dans le cas des basaltes du lac de lave de l'Erta Aie (Ethiopie)
o/
/o
An
1203
K.W
1205
M
1201
1173
1186
1042
1149
1164
1168
1182
1027
1144
1149
M
An 78 .2
An 68 .2
1237
An 65 .7
1231
Drake Weill
Drake
An 78.2
1299
1121
! An 68.2
1368
1098
I
1 Kb
0.5 Kb
K.VÍ
M
1241
1080
à sac
K.W
12 94
Thermométrie
optique
1170 + 20
mesures
in situ
11251175
mi*
1134
Or les travaux expérimentaux de Benharaou (197 6) sur ces roches
montrent que l1équilibre plagioclase-liquide se- réalise- pout une
température comprise entre 1170 et 1205°C dans des conditions
de PH20 très faible ( 1 bar).
Les températures obtenues par la méthode de Kudo-Weill, à sec
sont trop élevées (1294°c).
En revanche celle de Mathez donne une température (12O8°c)
plus proche des autres résultats, cependant il semble que
cette méthode ne peut s'appliquer que pour des PH20<£0.5 Kb
En effet la température augmente avec la pression d'eau,
ce qui est aberrant.
D'autre part si l'on teste ces deux géobaromètres, on constate
que l'équilibre plagioclase-liquide à 1170°C nécessite une
PH20 de 1.5 Kb pour Kudo-weill et de l'ordre de 0.3 Kb pour
Mathez (fig. 3) .
Dans ce cas le résultat de Mathez est encore le plus proche
de la réalité.
Les géothermomètres de Drake et Weill, et celui de
Drake - reflètent plus la basicité du plagioclase qu'un équilibre
plagioclase-liquide.
Fig.
3
Diagramme
Uleill.
température-F i
H2D de Kudo-
- 17 -
Même typa de comparaison dans le cas des basaltes d'Asal
-géothermomètre de Kudo Wèill :
O!
inclusion
roche
aphyrigue
roche
^ '"
cumulative
1368
1409
à sec |1321-1361
i
1314
1354
0.5 Kbl263-1307
1
1 Kb 1230-1270
1278
1319
5 Kb
1037
1086
1233-1244
1273
1317
0.5 Kb 1116-1128
1170
1231
1 Kb
1284
1338
978-1025
thermométrie
optique
124O-126O°C
- géothermomètre de Mathez
à sec
¡1234-1247
- géothermomètre de Drake et Weill
1336-1345
1346
1385
1004
1173
- géothermomètre de Drake
|ll28-1176
!
(1) : équilibre plagioclase-liquide inclus dans le plagioclase
(2) : équilibre plagioclase- roche totale aphyrique
(3) : équilibre plagioclase-roche totale cumulative en plagioclase.
- 18 -
Même type de comparaison pour les basaltes,
les andésites et les dacites du Tongan (Euart 19769
Summary of results of applications of various geothermometry methods to the Tongan lavas.
All temperatures in °C. and only ranges of calculated temperatures shown.
Basaltic andésites
Silicic
andésites
(Late,
Fonualei)
Dacites
(Fonualei)
Late
Hunga
Ha'apai
Tafahi
1,227-1,236
U10-U77
U48-U63
1,171-1,179
1,149-1,160
1,185-1.242
1,194-1,246
-
1,177-1,184
1,126-1,155
1,115-1,124
1,067-1,111
1,008-1,034
1,104-1,117
1.050-1,100
II. K u d o and Weill (1970)
Total rock + plagioclase core (1 bar)
Total rock + bulk plagioclase1 (1 bur)
Groundmass •+• plagioclase rim (1 bar)
Total rock + plagioclase core (0.5 kb)
Total rock + plagioclase core (1.0 kb)
1.325-1.339
1.281-1.342
1,153-1,171
U72-1.284
U38-U49
1311-1,383
132-1,348
1.128-1.164
1.256-1,326
1,220-132.
1349-1,364
1.271-1,283
U81-U86
1.060-1.153
1,205-1,216
1,165-1,179
U53-U72
1.192-1^43
982-1.085
1.196-1,213
1,155-1.173
III. Drake and Wcill (1975)
K S f (Plagioclase'/groundmassl
Ds, (PlagioclaseVgroundmass)
K B , (Plagioclase'/groundmass)
D B , (Plagioclase'/groundmass)
K c (Plagioclase'/groundmass)
D c . (PlagioclaseVgroundmass)
1.423-1.454
1308-1.336
1.480-1.572
1,409-1.476
1.172-1.339
1,152-1,242
1344-1,421
1.252-1319
1.417-1,457
1.357-1380
1,243-1,324
1,139-1,238
1371
1.282
1468
1,483
1,203-1,218
1,148-1,183
1,169-137
1,166-1^57
1,432-1473
1.397-1,517
954-1.111
948-1.087
IV. Sun, Williams, and Sun (1974)
Kj, (plagioclase'/groundmass)
D s , (PlagioclaseVgroundmass)
1.199-1^23
1,184-1,199
1.185-1,215
1,155-1,189
U00
1,171
1^OO-U33
1,108-1,157
Plagioclase Geothermometers
I. Mathez (1973)-1 bar
Total rock + plagioclase core
(sliquidus temperature)
Total rock + bulk plagloclase1
(~Iiquidus temperature)
Groundmass + plagioclase rim
(el bar quench temperature)
1,075-1,112
135-1,310
1,261-1,276
-
-
Conclusions
Les exemples cités montrent que les températures obtenues à
partir du géothermomètre. de Kudo-Weill, pour des roches
basaltiques et andésitiques sont toujours surestimées compte
tenu ./des PH2O.
Le géothermomètre de Kudo-Weill concerne surtout des roches de
composition granitique et donc des conditions de pression de
fluides différentes.
Le géothermomètre de Mathez semblerait mieux adapté aux roches
basaltiques et andésitiques à sec. Il donne des résultats aberrants
pour des PH2O 0.5 Kb.
Les géothermomètres de Sun et Ap , de Drake et Weill et celui de
Drake .inesurent la variation de la temperature en fonction de la basicité
du plagioclase.
- 19 -
2.3
Equilibre plagioclase-feldspath alcalin
2.3.1 Géothermomètre de Stornier (1975)
Ce géothermomètre se base sur la distribution de l'albite
entre le feldspath alcalin et le plagioclase coexistant dans la
roche.
Précédemment le modèle de Barth (1934) considérait lactivité de
l'albite égale dans le plagioclase et dans le feldspath alcalin.
Dans ce géothermomètre Stornier considère que la solution solide
Ab-An est idéale pour des compositions comprises entre Ab45 et AblOO
(l'activité de l'albite dans le plagioclase est alors égale à 1)
et que la solution plagioclase-feldspath alcalin n ' e s t pas idéale.
Il se base sur les données thermodynamiques nouvelles de Thompson
et Walldbaum (1969)pour formuler l'activité de l'albite dans le
feldspath alcalin,
d'où
ToK
__ (632 6.7 - 9953.2 X ¿ F + 943.3 X ^ . , +2690.2 x | p )
(-1.9872 Ln X A F / X p i)
+
+ (4.6321 - 10.815 X
A p
( 0.925 - 0.1458 X^p + 0.0141 x | F + 0.0392 x | F ) . P
+ 7.7345 X| F - 1.5572 x|p
AF : feldspath alcalin
Pi : plagioclase
X A F , Pi ' fraction molaire d'albite dans le f ldspath alcalin et
dans le plagioclase
P : la pression en bars
Les feldspath alcalin et plagioclase sont considérés comme des
solutions binaires dans lesquelles les substitutions Si, Al, Fe
ne sont pas prises en compte.
Ce géothermomètre est testé sur des roches trachytiques,
rhyolitiques et shoshonitiques et comparées aux températures .
obtenues par l'équilibre oxydes Fe-Ti.
Critique :
L'estimation de l'équilibre entre entre feldspath alcalin
et plagioclase est difficile quant au choix des compositions
étant donné la zonation de ces cristaux. Cependant, ce géothernonètre
peut être pris corme critère d'équilibre entre ces deux minéraux lorsque les
températures sont géologiquement raisonnables.
Brown et Parson pensent que ce modèle trop simple ne peut
s'appliquer q u ' a u x feldspaths alcalins pauvres en albite.
Les températures calculées à partir de l'équation de
Stormer pour des roches de séries alcalines (Nuku Iva, Mont Dore)
(Maury 197 6) sont aberrantes (1600 à 6000°C).
-
2.3.2
20 -
Geothermomètre de Powell et Powell
Ces deux auteurs proposent la modification du géothermomètre
précédent, en considérant le feldspath alcalin dans le système
ternaire K - N a - C a .
D ' o ù le terme de Stormer (l-X,T
. „ ) devient X„ . „
„
ToK
= -
X
K,AF
JMajAr
j
(( 6 3 3
R Ln Kd + 4
Kd =
°
+
i A p
°-
093 F + 2 X
K.jAr
j
Na,AF (*34O
(
+ 0.019 P)
( -4.63 + 1.54 X ^
Ap)
X
Na,AF / XNa,Pl
P : pression en bars
Ce géothermomètre est testé par les auteurs sur des exsolutions
dans des pertites d'une syenite. Les températures obtenues sont
comparées à celles calculées à partir du géothermomètre
néphéline-feldspath alcalin des mêmes auteurs.
Ce géothermomètre appliqué aux mêmes roches que celui de Stormer
donne des solutions impossibles.
Brown et Parson (197?) le jugent
simplifications faites.
inacceptable à cause des trop orandes
- 21 2.4 Equilibre olivine-liquide
2.4.1
Géothermomètre de Boeder et Emslie (1970)
Bowen et Shairer (1935) avaient étudié
expérimentalement
le système MgO-FeO-SiO2, et montré que la solution forstéritefayalite était une solution idéale.
A l'équilibre la réaction entre olivine et liquide est la suivante :
Mg (ol) + F e 2 + (liq) ;
* Mg (liq)
+
Fe2+
(ol)
Les travaux expérimentaux de Roeder et Emslie (1970) sur la
répartition de FeO et MgO entre l1olivine et le liquide coexistant
se basent sur des roches naturelles (basalte, ankaramite, andésite )
pour un intervalle de température de 1150 à 1300°C, et pour une
atmosphère de pression.
Ces auteurs montrent :
- la corrélation linéaire entre les coefficients de partage
et Bp 0 et la température :
/ x£jq
= 3740 / T - 1.87
Log X°l0 / X^jg = 3911 / T - 2.50
- que le coefficient de distribution Kd
varie très peu (0.26 à O.36) dans l'intervalle de température
considéré par les auteurs.
La stabilité de ce coefficient Kd peut alors être utilisée
comme le témoin de l'équilibre olivine-liquide.
Cepandant Mysen (1975) démontre dans ses travaux sur les péridotites
l'extrême variabilité de Kd en fonction de la température, de f02,
et des compositions des liquides à haute pression (lO à 25 Kb)
Le Kd de Roeder et Emslie ne sera donc utilisé que dans des conditions
physico-chimiques proches des conditions expérimentales.
D'autre part le calcul de la température à partir de l'équation 2
nécessite une bonne détermination de Fe2O3 dans le liquide.
2.4.2 Géothermomètre de Roeder (1974)
Roeder apporte une modification empirique à son géothermomètre
après avoir étudié l'influence des alcalins et de l'aluminium
sur la solubilité de MgO dans le liquide, ainsi que le comportement
de Mn et de Ca.
Il montre que la solubilité de MgO (en accord avec Leeman 1978)
dans le liquide décroit lorsque la teneur en alcalins et le rapport
Si/0 croit. Il en va de même pour FeO etpar extrapolation pour MnO.
Ses données viennent
confirmer celles de Roder et Emslie :
le Kd Mg-Fe es"t indépendant de la température dans les conditions
citées précédemment , et démontrent que
KdFe-Mn
= ( X F e 0 / X M n 0 ) o 1 . (X M n 0 . X F e 0 ) l i q = 1.4
- 22 -
à l'équilibre.
La détermination expérimentale du coefficient d'activité de FeO
et celle des coefficients de partage de MgO, MnO, FeO permettent
de redéfinir trois nouvelles équations :
pour MgO
3480 / Log(MgOo1 /MgO l i q ) +-
T°K =
pour FeO
T°K =
pour MnO
T°K =
3740
1#7
°
/ Log (FeO o1 / FeOlicl) +2.38
3850 / Log (MnO o1 / MnO l i q ) +2.59
2.4.3.Géothermomètre de Leeman et Scheidegger (1977).
Ces auteurs formulent empiriquement S géothermomètres
basés sur la répartition de Mg, Fe, Mn, Ni, Co entre l'olivine
et le liquide coexistant, en fonction de la température
de la forme :
Ln D. = A / T
+B.R
où D est le coefficient de partage de l'élément entre l'olivine et
le liquide.
A, B, R sont les coefficients de regression détermines à partir
de roches naturelles ( basaltes picritiques, tholeiites à olivine.
ferrobasaltes), leur valeur est donnée dans le tableau ci-dessous :
A
MgO
MnO
FeO
NiO
Co
B
R
8916
4.29
O.99O
12184
9OI6
I316O
7.96
5.46
0.991
9676
= ¿A/A
6.18
5.23
O.987
O.991
O.968
AT/T ' '
12%
7%
1036
1556
7%
+ . 4B.R / B.R
Les taipérafcures calculées à partir des différents éléments sont considérés
conme valables si l'écart entre les extrêmes est inférieur à 100° C .
Ce géothermomètre, comme le précédent, ne peut s'appliquer q u ' a u x
roches semblables à celles des auteurs,
compte tenu de la
dépendance de Dj^W) (Leeman 1978), Dj^ o (Watson 1978, Takahashi 1978)
vis à vis de la composition des liquides, de la pression.
Les températures obtenues sont comparées par les auteurs à celles
de Kudo-Weill ou bien aux températures expérimentales.
- 23 2.4.4.Géothermomètre de Leeman (1978
Leeman affine empiriquement le géothermomètre précédent basé
sur le coefficient de partage du Ni, en élargissant et multipliant
le nombre de mesures faites sur les roches naturelles et les verres
synthétiques, entre 1070 et 1400°C.
D'où
DNi T
et D N i
AT /
sur
Les
des
=
NiO o 1
=
A / Ln D N i
+ B
=
12442 / Ln D N i + 5.55
/ NiO l i q '
T =
A A/A + A B / B = 1 0 $
en ne considérant que l'erreur
les coefficients de regression.
valeurs de A et B données ici sont celles obtenues à partir
roches basaltiques.
2.4.5. Géothermomètre de Hart et Davis (1978)
Hart et Davis étudient expérimentalement les variations
du coefficient de partage du nickel (Djji) entre l'olivine et le
liquide, dans le système Ab-An-Fo, à pression atmosphérique
et pour une température variant de 1250 à 145O°C.
Ils montrent la dépendance de Dj$± vis à vis :
- de la teneur en Si02 du liquide.
Pour des roches dont le rapport Si/0 = 0.30 la relation suivante
est satisfaite :
LnD Ni
= 12 345 / T°K
-
5.593
Ces résultats sont très proches de ceux de Leeman (1978);
en revanche ils diffèrent considérablement de ceux de Arndt (1977)
obtenus pour des ultrabasites. Ceci veut dire que ce géothermomètre
s'applique à des roches dont le rapport Si/0 =* 0.30, et dont les
conditions de cristallisation sont celles des roches basaltiques
(pressions eelativement faibles).
En effet, de nombreux travaux sur le coefficient de partage D^i
vont dans le sens de ces résultats et montrent la dépendance
de
DJJÍ vis
- de la
- de la
- de la
Kushiro
- de la
à vis
:
teneur en alcalin et Si02 du liquide (Irvine et Kushiro 1976)
teneur en Si02 et MgO du liquide (Hart et Davis 1978)
pression totale et de la teneur en H20 du magma (Mysen et
1978)
f02 (Mysen et Kushiro 1975).
- 24 2.4.6. Comparaison entre les températures obtenues à partir des
différents géothermomètres basés sur l'équilibre olivine-liquide.
6.1. Sur les basaltes picritiques du Kilauad Iki et Mauna Loa
(Hawaii) de Leeman et Scheidegger.
N° ech.
Kl 5
KD
0 .22
T°C
Leeman
et Al.
MgO
+
Roeder
Kl 7
ML 82
0.32
0.26
T°C
T°C
Leeman
et Al.
Roeder
j
Leeman ¡ Roeder
et Al. 1
1189
1185
1126
1123
1259
1198
1157
1152
1095
1079
FeO
1294
1305
1217
1228
1268
1268
1192
1208
1269
II36
II95
MhO
1281
1241
1264
1233
0
•
Kl
Kl 7
Leeman
Scheidegger
NiO
Leeman
1186
1187
ML 82
Leeman
'Leeman
Scheidegge r|
1231
!
Leeman
¡leeman
Scheidegger
1149
1233
!
1
II46
Les deux températures obtenues pour chaque élément correspond à deux
méthodes analytiques (microsonde électronique, absorption atomique)
(°) FeO = FeO total _ 1.5% de Fe2O3
6.2. Sur les basaltes d'Asal. Comparaison entre les températures obtenue
à partir de différents équilibres ,'
Liquide inclus
RT. cumulative
R.T aphyrique
FeO tot
0.26
O.I9
O.I9
Kd
0
FeO
O.3O
O.23
O.23
T°C
^eeman
MgO
T°C
Roeder
Leeman
T°C
Roeder
Roeder
Leeman
1108
1044
1218
1157
1145
IO85
FeO to b 1220
I209
1283
1207
!
1234
Hol
FeO°
1168
1246
II72
i
II88
1117
1241
(°) FeO = FeO total -1.5% Fe2O3
(+) géothermomètre de Leeman et Scheidegger
- 25 6.3. Sur les basaltes tholeiitiques du lac de lave de Makaopuhi
(Hawaii) (Hakli et Al 1967)
N° ech.
M 12
M 1.6
M 21
T°C_
Leeman
j Roeder
et Al. |
T°C
Leeman Roeder
I
T°C
Leeman ', Roeder
et Al. ' :
MgO
1139
II38 '• IO62
FeO
IIO9
1125
II92
NiO
1160
mesures
in situ
FeO
IO7O
= FeO total -1.5%
1120
1075
Fe2O3
Plusieurs remarques s'imposent à la lecture de ces résultats :
Les différences entre les températures obtenues à
partir du géothermomètre de Leeman -Scheidegger et celui de
Roeder sont systématiques : 60°C avec MgO et 70°C avec FeO.
Cependant en calculant l'erreur faite sur la température
(en considérant que l'erreur sur la température est égale
à la somme des erreurs sur les coefficients de regression A et B)
à partir des équations de Leeman et Scheidegger; on trouve
pour l'échantillon ML 82 (§ 6.1) :
T
AT
MgO
II89
± 143 °c
FeO
1294
MnO
I28I
± 129 °c
+ 90°c
NiO
II87
+ 178°c
Compte tenu de ces marges d'erreur il semble difficile de
donner une signification aux écarts précédents.
L'analogie entre les températures de Roeder
et celles mesurées in situ est • très bonne dans le cas des
tholeites du lac de Makaopuhi.
- 26 -
Les températures de Leeman-Scheidegger et de Leeman
obtenues à partir de NiO sont cohérentes entre elles et avec
les températures calculées à partir des autres éléments, mais
toujours trop élevées par rapport à celles de Roeder.
La concordance entre les températures obtenues
à partir de différents éléments et pour une même méthode
est d'autant meilleure que le Kd olivine liquide est proche de 0.30
L'exemple des olivines d'Asal (§ 6.2) montre.
l'importance de Fe2O3 dans le calcul du Kd et de la température.
En effet, les températures diffèrent de 40°C selon que FeO
du liquide est calculé en FeO total ou égalé à FeO tot - 1.5%
de Fe2O3.
Malgré toutes ces remarques, on peut constater que
les températures-varient-toujours dans-le même sens et prouvent
ainsi la valeur relative de celles ci.
-
27 -
2.5. Equilibre olivine-clinopyroxene-üquide
.5.1.Géothermomètre de Hakli et Wright (19Ó7)
Ces auteurs se basent sur le coefficient de partage
du nickel entre olivine-clinopyroxene-liquide pour formuler un
géothermomètre empirique.
Ils montrent dans leurs travaux sur les basaltes £holeiitiques
du lac de lave de Makaopuhi, la corrélation entre les différents
coefficients de partage du nickel (olivine-liquide, olivineclinopyroxene, clinopyroxene-liquide) et la température :
Ln DNi
ou
= -
AH/ RT
+
B
AH est l'enthalpie
R la constante des gaz parfaits : I.9872 cal/°/mol.
Les valeurs des constantes
H et B obtenues à partir des
tholeiites citées sont résumées dans le tableau ci- dessous
B
H
%i
Niol/Niliq
N i cpx/ Ni liq
'
N i o 1 / Ni°P x
- 7400
O.O3
-248OO
- 7.85
7.65
I68OO
Les températures utilisées pour déterminer AH et B avaient été
mesurées in situ.
Les auteurs attirent l'attention sur le fait que 1'
application de ce géothermomètre à d'autres types de roches est
très délicate, car l'effet de la pression ainsi que celle des
fluides n'est absoluement pas controllé.
2.5.2.Applic ation
Hakli (1968) utilise la même méthode pour trouver
la température de mise en place d'une intrusion gabbroïque
au S.E de la Finlande.
Aussi cet auteur calcule les coefficients de partage du nickel
entre différents couples :
- olivine-orthopyroxene
- olivine-hornblende
- orthopyroxene-augite
- hornblende-augite
Ayant calculé la température à partir du géothermomètre
précédent, et pour les différents couples cités, Hakli
redétermine de nouveaux coefficients
pour la relation
Ln D N i
= -A /T
d'où les valeurs ci-dessous
+ B
- 28 -
olivine-augite
A
8647
B
7838
olivine-orthopyroxene
4969
4977
olivine-hornblende
4664
4433
orthopyroxene-augite
3664
2851
hornblende-orthopyroxene
2840
O.528
hornblende-augite
•3969
3,395
Ces équations sont très rarement utilisées.
2.5.3. Géothermomètre de Glitsch et Allègre (1979)
Ces auteurs proposent une méthode de calcul de la
température originale, basée sur le coefficient global
de partage de nickel, et pour laquelle seule l'analyse
de la roches totale est nécessaire.
Ils 1 ' appliquent à 5**oches appartenant à différentes séries :
- un trachyte de Terceira (Açores) à olivine-plagioclase-augite
- un trachybasalte de Florès (Açores) à olivine- plagioclase_
augite-orthopyroxene
- une tholeiite d'Islande à plagioclase-olivine-augite-orthopyroxen
- une téphrite du Cap Verde à augite et plagioclase
- un basalte de l'île de Grenade (Antilles) à olivine-plagioclase.
Le coefficient de partage global D est donné par la relation
de Neumann (1954)
N
Dft
= X
Da . X a (1)
où
et
est la phase minérale
Dfl
coefficient de partage de l'élément entre le minéral et
le liquide
XQ,
le % pondéral de la phase minérale dans la roche.
Leur calcul se fait en plusieurs étapes :
- Calcul du coefficient de partage globale D
II suffit de correler Ni d'une phase
avec un autre élément
en trace ( dont D <.-: 1 ) dans cette même phase.
D est donné par la pente de la droite ainsi obtenue.
- Calcul de X Q
La coviposition
de différentes phases minérales ainsi que
leur % pondéral dons la roche s b n t obtenus à partir d'un
programme de calcul (Provost et Allègre 1979) et à partir
de l'analyse chimique de la roche totale.
- 29 -
- Connaissant. Da et Xa-et en remplaçant Da
par les différentes équations ci-dessous, il est possible
alors de résoudre l'équation (l) en fonction de la température.
Log D ° j / l i q = 12345 / T°K
Log DNi§/1:Lq
= 29220 / T°K
- 5.593
-
6.18
Log D$jPx/1:Lq = 22109 / T°K - 13.2
de Hakli et Wright 1967 et Hakli 1968)
(Hart Davis 1978)
(Lindstrom 1976)
(déduit des équations
Pour Florès et Terceira les températures obtenues sont comparées
aux températures calculées à partir du géothermomètre plagioclaseliquide de Drake (1976) (§ II.5);
et pour les tholeiites d'Islande aux températures expérimentales.
Une bonne concordance est observée sauf pour les trachytes de
Florès.
Cette méthode peut être intéressante car elle
se base sur l'analyse chimique de la roche totale et non sur celles
des phases minérales.
Cependant, toutes les solutions mathématiques que l'on obtient
nécessitent des hypothèses ( pétrographiques
ou autres) qui ne
sont pas toujours vérifiées.
- 30 2.6. Equilibre orthopyroxene- clinopyroxene
2.6.1. Géothermomètre de Wood et Banno (1973)
Ce géothermomètre se base sur la répartition de
Mg2+ et de Fe2+ entre clinopyroxene et orthopyroxene en
équilibre.
Wood et Banno s'appuient sur les travaux expérimentaux :
- de Davis et Boyd (1966) sur le domaine d'immiscibilité
Di-En, à 30 Kb de pression qui considèrent la relation :
( Mg2Si2O6) opx ^=5T (Mg2Si2O6) cpx
solution
solution
En-Di
Di-En
- de Smith (1972) sur le système CaSiO3-FeSiO3-MgSiO3
- de Lindsley et Munoz (1969) sur le joint
Hd-Fs.
pour formuler le géothermomètre suivant :
Ln(
" 5Í2°6
ou
Px
Mg2Si2O6
= c
et
X „
est la fraction cationique de Fe dans 1'orthopyroxene
x* G
Les auteurs considèrent que :
la répartition de Mg et Fe entre les sites Ml et M2 des
pyroxenes se fait de manière aléatoire
(Mg/Mg + Fe)
x
=
(Mg/Mg + F e ) M 1 Q u
M2
que le site Ml reçoit les cations Si, Al, Ti, Fe^ , Fe 2 + , Mg
et le site M2 les cations Ca, Na, Mn, Mg, Fe
Les coefficients A, B, C sont déterminés à partir de rhyolites
naturelles, dans lesquelles la température est donnée par
l'équilibre oxydes Fe-Ti d'où
C = 7.65
D = - 3.88
B = 4.6
Ce géothermomètre est testé par les auteurs sur des roches très
différentes : péndotites, ch^rnockites, basaltes, andésites
et rhyolites.
- 31 -
Les tempéra-bures obtenues sont comparées soit aux températures
expérimentales soit aux températures données par l'équilibre
oxyde Fe-Ti.
Critique
Fleet montre (1974) que la répartition de Fe et de Mg
entre les deux sites des pyroxenes dépend
- de la nature de la roche- de la teneur en FeSiO3 du pyroxene
et que Fe entre préférentiellement dans le site M2 du pyroxene '
Wells reproche aux auteurs de s'être basés sur les travaux de
Davis et Boyd faits sous 30 Kb de pression et pour des pyroxenes
pauvres en Al et Fe.
2.6.2. - Géothemotiètre de Wells (1977) .
Cet auteur critique et modifie empiriquement le
géothermomètre précédent en se basant sur de nouvelles données
expérimentales sur le domaine d'immiscibilitë des pyroxenes
(Lindsley et Dixon 1976).
D'où la nouvelle équation
ToK
=
7341
3.355 + 2.44 X°P X
- Ln K
où
K
K
=
cL c
p X
Mg2Si2O6
/ oC
'
O p X
Mg2Si2O6
Ce géothermomètre devrait être mieux adapté aux riches en Mg.
2.6.3. Géothermomètre de Sun, Williams et Sun (1974)
Ces auteurs montrent sur les basaltes des rides
océaniques (de même que pour les plagioclases) la corrélation
linéaire entre le coefficient de partage D„ ( clinopyroxeneliquide) et la température :
Log D S r = 18430 (+ 2140) / T - 13.62 (+ 1.49)
Compte tenu de l'erreur sur les coefficients de regression
on trouve 22% d'erreur sur la température.
2.6.4.Géothermomètre de Saxena et Nehru (1975)
Ce géothermomètre se base sur la répartition de
Fe, Mg, Ca entre clinopyroxene et orthopyroxene à l'équilibre.
Il se construit à partir de l'équation suivante :
- RT Ln K = - RT Ln <*cpx/ o< °P X
A
= ¿G° = 500
G° est l'enthalpie libre standart déterminée expérimentalement
(Nehru et Willye 1975) pour une température de 1100 à 1400°C.
- 32 -
et all
: l'activité de Mg dans le pyroxene
Ml
M2
M2 , px
j
Mg * X Mg * ]
X
^
: fraction molaire de Mg dans les sites Ml et M2
du pyroxene
V
: coefficient d'activité de Mg dans le site M2
donné par la relation suivante
M
R T Ln
V
M2 _
Mg "•
W
M2
Mg-Ca
X
M2
Ca-opx
-fJ12 V x M2,
Ca + X Fe >
(X
W est le paramètre d'énergie d'activation déterminé expérimentalement pour 1100, 1200 et 1300°C,- sa valeur résulte de la
moyenne de plusieurs valeurs trouvées.
W
=
7184
pour l'orthopyroxene
W
=
653I pour le clinopyroxene
Dans ce modèle les auteurs font les hypothèses suivantes :
- Fe et Mg : forment une solution binaire dans le site Ml
- Ca, Fe, Mg : une solution ternaire dans le site.M2,
Ca, Mg étant une solution non idéale
(d'où le terme
exprimé ci-dessus)
- que le site Ml reçoit les ions Fe, Mg
- et le site M2 les ions Mg, Ca, Fe
et M2
(Mg
/ MS
+
Fe)
Px
A partir des équations 1 et 2 on déduit la relation suivante :
Cpx
x
T°K = l/RLn o/
• /'K°P
(~WM2
2
M 2
2
X Mua
(X„Ca+X„Fe)cpx
+ W M 2 X MCa
( X Ca+X F~^'M 2 - 500
Ce géothermomètre n'est pas testé par les auteurs.
Ils soulignent, d'ailleurs que ce calcul doit être considéré
comme une première approximation de la température, compte
tenu des hypothèses de départ.
Il faut remarquer que les pyroxenes ont été considérés
comme une solution Ca, Fe, Mg seulement.
- 33 2.6.5. Géothermomètre de Ross et Huebner (1975)
A partir de matériaux naturels, ces auteurs
déterminent expérimentalement , à pression atmosphérique, les
températures de coexistance de trois phases - pigeonite,
augite, orthopyroxene- pour différentes compositions de ceux ci
Leur diagramme est réprésenté figure 4 •
2.5.6. Application de ces différents géothermomètres
5.1. Pour les basaltes andésitiques du Tongan (Ewart et Al 1976)
ainsi que pour des andésites
basalte
andésite
d acite
Pyroxene Geolhermoeters
V. Sun, Williams, and Sun (1974)
K s , (augite/groundmass)
D S ( . (augite "/groundmass)
1,231-1,235
1.182-1,184
1,219-1,229
1,171-1.172
:
VI. W o o d and Banno (1973)
Opx-Cpx equilibrium
1,049-1,125
1,088-1,105
1.014-1,099
971-1,002
921- 952
VII. Saxena (In prep.)
Opx-Cpx equilibrium
1,057-1,082
1,047-1.057
992-1,197
950- 997
942- 987
U33
1,184
1,234-1,251
1,178-1.189
Les températures de Wood-Banno et celles de Saxena sont très
proches, elles sont cohérentes d'après l'auteur avec l'histoire
de cristallisation des roches pour les basaltes et les andésites.
En revanche dans le cas des dacites et celui des andésites
les différences entre les températures obtenues à partir de
l'équilibre opx-cpx (900-1000°C) et les températures données
par l'équilibre plagioclsâeliquide ( 1100°C) sont inexplicables.
6.2. Aux K-benmoreites (Maury 1976) et ponces (Menard 1978)
du Mont Dore
méthode
ponces
T°C
K. benmoreite
T°C
Wood-Banno
769
1
836
Wells
743
803
2
762
705
1 et 2 représentent deux couples de pyroxenes :
pour un même rapport Mg/Fe le clinopyroxène 1 est enrichi en
A12O3 par rapport au clinopyroxène 2 ( respectivement
A12O3 = 6.7$ et 3.156)
to
H-
«o
. TV
to
X
•**>
F
Fig 4
Tenperatuxe-coir.çosition (mole •%) relationships in the zero to
5 Kbar ra:ige for the r.aturaily occurrir.j assemblages pigeor.ite-augite,
orthopyroxor.e-pigeoni^e-a^tjite, and metastable pigeonite-auçits piorted
in the pyroxene subsciidus ternary phase volume T-{CaSiO3-;;çSiO3-FeSiC3 ).
The dashed lines show -che metastabie extension of the pigeonire liri of
the pigconite-a'jgite solvus beiow uhe three-pyrcxene region. The tlorcepyroxene trir.nqles ars shown in increments of 50°C- As pressure
increases the critical curve is displaced to higher temperatures witn a
concomitant expansion or the soJ\rus. This effect, however, is r.ou
significant ac pressures up zo i Kbar. Assen±>lagec containing pigeonice
with FeSiO} consent, of greater than 70 mole perçant are stabilized »or.iy
at elevated pressures ID. Smith, An. Minorai. , vcl. 57, p-, 1413, 1972).
- 34 -
et de même pour les deux orthopyroxènes correspondant.
Ces deux méthodes donnent des résultats très semblables
Elles sont très liées à la teneur en A12O3 du pyroxene.
Or les pyroxenes étant très souvent hétérogènes (secteur riche
en A12 03 •••) le choix des compositions pour ce calcul devient
délicat.
- 35 -
2.7•Equilibre olivine-clinopyroxène
2.7.1. Géothermomètre de Powell et Powell (1974)
Ces deux auteurs formulent un géothermomètre basé
sur la répartition de Fe et de Mg entre l'olivine et le
Clinopyroxène coexistant :
-2XA1(92OGCG + 3.6 P) - '0.0435 (P-l)
T K =
°
+10100
8 + 2(RLn(xS¿/ x £ ) . (x£/ ^ ¿ ) p x ) - 714.3 (2 X A1 )
R : I.9872 cal/°/mol.
P
: pression en bars
X_
-, : fraction molaire de Fo et Fa dans l'olivine
Xp e
„
^
: fraction atomique de ces éléments dans le pyroxene
xA1
=
xT. + x A 1 + x C r + x F e 3 +
La répartition de Mg et Fe dans les deux sites du pyroxene
se fait selon la loi suivante
( Fe / Mg îM 1
etM2
= ( Fe / Mg )
p x
Les données thermodynamiques sont soit empruntées à la littérature
soit déterminées empiriquement à partir de laves naturelles
sur lesquelles la température est estimée à partir de
l'équilibre oxydes Fe-Ti.
Ce géothermomètre est appliqué par les auteurs sur des roches
très diverses : gabbros, basaltes, rhyolites, lherzolites.
Critiques
Toutes les températures calculées à partir de
l'équation donnée- se regroupent autour de 10CC°C (Maury 1976).
Wood (1976) reprend ce géothermomètre et le teste sur des
lherzolites. Les résultats qu'ils obtient sont très différents
des températures estimées par le géothermomètretde Wood et Banno
ou à partir des travaux expérimentaux de Davis et Boyd (1967).
Wood porte ses critiques :
- sur le choix des pyroxenes (dans lesquels le rapport Al/Ti
eeste constant et égal à 0.5^ alors qu'il varie facilement de
1 à 4).
- sur l'hypothèse que Mg / Fe est égal dans les deux sites du
pyroxene
- sur le choix trop sélectif des laves
- sur le domaine de températures exploré trop restreint (145°C).
Cet auteur conclut que ce géothermomètre est inapplicable
sous sa forme actuelle.
- 36 -
2..Q. Les géobaromètres
2.8.1. Géobaromètre de Sun, Williams et Sun (1974)
Ce géobaromètre se base sur le coefficient de partage .
de I 1 europium (D]?u) entre plagioclase-liquide ainsi que
clinopyroxène-liquide.
Les conditions d'expérimentation sont extrêmement restrictives :
basaltes de ride océaniques, températures variant de 1140 à ÎIOCC,
et f02 de 10-8 à ÎO"1^.
Le calcul des coefficients de regression dans ces conditions
permettent de formuler deux équations
Log D E u = 246O / T - O.15 Log f02 - 3.87
Log D E
=
pour le plagioclase
635O / T + O.O4 Log f02 - 4.49 pour le clinopyroxène
Ces résultats diffèrent de ceux de Drake (l97Í)(§ VII.2)
Cependant, il semble évident d'après les travaux de Morris
et Haskin (1973) que ces écarts sont liés à la différence
de composition chimique des roches de départ.
Il est aussi important de remarquer que l'erreur faite sur
f02 ( en considérant que l'erreur sur f02 est la somme des
erreurs faites sur les coefficients numériques uniquement)
est de l'ordre de 50$.
2.8.2.
Géothermomètre de Drake (1975)
Ce géothermomètre se base sur le rapport Eu3+/Eu2+
dans le plagioclase et dans le liquide coexistant de composition
basaltique et andésitique.
Il se formule ainsi :
pour le liquide :
Log F02 = - 4.55 Log Eu 2 + / E u 3 + - 10.89
(l)
pour le plagioclase :
9+
04.
Log fO2 = - 4.60 Log Eu
/ Eu J - 3.86
(2)
Le problème est de déterminer le rapport Eu
seul 1'europium total étant dosé.
Sachant que D 3 = Eu3+/ Eu^t
= O.O78
Admettant que Do = Eu2+ _ , _ 2+ n .
z
pi / Eu liq
+
/ Eu3+
0.03 (Drake, Weill 1975)
~
= Dg r
- 37 _ _
Eu2+ et
Eu°3+sont donnés par les deux équations suivantes :
Eu 3+ =
liq
2+ EuIxq
Pi
- DSr
. Eu,.
liq')
liq - Euliq
Les marges d'erreur sont données ci-dessous :
E u 2 + / Eu3 +
Log f02
4 Log f02
plagioclase
16
- 10.9
+ 1.2
liquide
0.15
- 6.3
+ 0.45
2.8.3.
Application de ces géothermcinètres
3.1. Application aux basaltes du Snake River Plain (Leeman et Al
1976)
Drake
tog f02
Buddington et Lindsley
- 10.9
- 10.5
Ewart (1974) estime que la dépendance de D_ entre le plagioclase
et le liquide n'est corrigée ni par 1'équation de Drake ni par
cette de Sun.
De toutes façons il faut être conscient des limites d'application
de ces méthodes étant donné la marge d'erreur.
2.8.3.
Géobaromètres basés sur les équilibres biotite-magnetitesanidine, opx-cummingtonite-quartz.
De nombreux travaux (Wones et Eugster 1965j
Wones 1972, Ewart 1975) basent le calcul de P H20 sur la
réaction
Annite + ^ 02
sanidine + H20
+ magnetite
d'où
Log de fH2O = 7409/T +4.25 +^Logf02 + 3LogXp 2+ 2logX"0K
Fe'
où
Log a
KAlSi3O8 - L o g
a
Fe3O4
T est la température en °K
X p 2+ la fraction atomique de Fe dans 1'annite
X0K
= 0H / 0E + F
-
38
-
Ce géobaromètre nécessite la connaissance de la température et
de la fO2 ainsi que la détermination de OK et Fe2+ dans la biotite,
D'autres équilibres sont utilisés (Ewart 1971j
Wood 1979) :
orthopyroxène-quartz-cummingtontie:
7 MgSiOS
+
SÍ02
clinoenstatite
quartz
+ H20
K2C *•
,
Mg y Si g 0 2 2 (0H.) 2
,
antophylitte
d ' où
o cummingtonite
Log fH20 = 4683/T + 7473 + O.112(P-1)/T + Log (
3a
px
^g
_
X
)7
aliq
M g J * a Si02
M2
Ml . y
Mg
.
cummingtonite
pSr
_
Cette réaction nécessite la connaissance de la pression totale (F)
de la température et de l'activité de la silice dans le liquide.
D'autre part Ewart (1974) note qu'un changement de 10°C de la
température induit une erreur de 0.54 Kb dans la P H20
et une erreur de 0.01^ ëur 3Û, dans le pyroxene engendre une
erreur de 0.74 Kb.
- 39 -
III - Autres méthodes : géothermomëtrie expérimentale
3.1. Pétrologie expérimentale
La pétrologie expérimentale sur roche naturelle a pour but
d'établir directement par expérience dans des conditions physiques
déterminées les relations d'équilibre entre phases minérales. Cette
technique, qui a connu un essor important depuis une vingtaine d'années a principalement été utilisée pour tester les hypothèses sur
l'origine et les conditions de cristalisation des magmas.
L'expérimentation sur roche naturelle permet de reconstituer
les conditions physiques prévalant lors de l'apparition des minéraux
cristalisant successivement dans les magmas. Les échantillons traités
doivent être subaphyriques afin de se rapprocher d'aussi près que possible de la composition des liquides successifs.
La manipulation consiste à soumettre l'échantillon naturel
à des conditions expérimentales dont on connaît et contrôle les paramètres tels que composition d'atmosphère (teneur en oxygène, ou fugacité
de l'oxygène), température, temps, pression. L'observation et l'analyse
des produits obtenus permet alors, pour une variation des paramètres, d'en
déduire les relations entre phases apparues et d'explorer ainsi partiellement
un espace T, P, P02. Cette méthode classique dite "des trempes"est largement
utilisée, notamment en Grande Bretagne et aux Etats Unis ; elle a récemment
été utilisée en France par G. Benhamou (1976) qui présente dans son travail
une description détaillée de la méthode et des exemples de son application
à diverses séries de roches volcaniques.
3.2. La thermométrie optique
La thermométrie optique est une méthode directe de mesure de
la température.
Elle consiste à suivre l'évolution des inclusions vitreuses
présentes dans les cristaux des laves, lors d'une élévation de la température sous le microscope de chauffe.
- 40 -
Ces inclusions vitreuses constituées par un verre et un vide
de retrait (formé lors du refroidissement) s'homogénisent sous l'effet
de la température lorsque le vide de retrait disparait. Massare (1979)
montre que pour une P < 10 Kb, température d'homogénéisation et tenpérature minimale de cristallisation du cristal peuvent être confondues.
Cette technique complète et souvent remplace les géothermomètres classiques qui dans certains types de roches ne peuvent pas
s'appliquer ou donnent des résultats douteux.
Elle est moins onéreuse que la méthode précédente, mais ne
permet pas de vérifier les conditions de pression prévalant lors de
la cristallisation des minéraux.
- 41 -
IV - Programmes établis pour la HP 97
(voir annexe)
4.1. Gêothentonëtres
Oxydes Fe-Ti
- Buddington et Lindsley (1970)
- Powell et Powell (1977)
Plagioclase-liquide
- Kudo-Weill
- Mathez (1973)
- Sun-Williams-Sun (1974)
- Drake-Weill (1975)
- Drake (1976)
Plagioclase-feldspath alcalin
- Stornier (1975)
- Powell-Powell (1977)
Olivine-liquide
- Roeder Emslie (1979) : calcul du Kd
- Roeder (1974)
- Leeman et Sheidegger (1977)
- Leeman (1978)
. Orthopyroxène-clinopyroxène
- Wood et Banno (1973)
- Sun-Williams et Sun (1974)
- Saxena-Nehru (1975)
- Wells (1977)
Olivine-clinopyroxène
- Powell et Powell (1974)
- 42 -
4 . 2 . Géobarctnètres
Sun-Williams et Sun (1974)
Drake (1975)
Powell et Powell (1977)
- 43 -
V - Conclusion
La plupart des roches volcaniques contiennent des minéraux
auxquels il est possible d'appliquer un ou plusieurs gêothenranëtres
ou géobaromètres.
De telles applications nécessitent diverses précautions,
de plusieurs ordres :
- d'ordre théorique tout d'abord, les géothermomëtres et
géobaromètres s'appliquant de manière restrictive à certains types
d'assemblages.
- d'ordre pratique ensuite, les diverses phases minérales
n'étant pas toujours en équilibre entre elles ou avec la roche dans
laquelle ils se trouvent.
- d'ordre analytique enfin, certains minéraux étant zones,
psrthitiques et les liquides étant rarement vitreux et aphysiques.
La présente recherche bibliographique montre qu'il est
possible d'évaluer température et pression à partir de l'analyse de
certains minéraux et des roches les contenant.
Ainsi pour les roches à ilménite-titancmagnétite coexistant,
le géothermomètre de Buddington et Lindsley semble reconnu pour donner
des températures cohérentes avec le type d'évolution des magmas correspondant. Il peut donc s'appliquer aux roches des séries alcalines,
tholeiitiques et transitionnelles.
Pour des roches tels que les basaltes picritiques tholeiitiques,
alcalins et les ankaramites, (c'est à dire des conditions de basse pression en fluide) et dont le Kd (de Roeder et Emslie) est proche de 0.30,)
le géothermomètre de Roeder (1974) donne des températures en bon accord
avec les températures obtenues par d'autres méthodes.
En revanche, pour des pressions équivalentes, les températures
calculées à partir des équations de Leeman et Scheidegger (1977) sont
toujours surestimées de 60 à 70° C (pour MgO et FeO).
Cependant, l'erreur sur ces températures étant de l'ordre de
100 à 150° C, cet écart est peu significatif.
•••/•••
- 44 -
Pour des basaltes picritiques, tholeiitiques, alcalin et des
ferrobasaltes, dont le rapport Si/o est de l'ordre de 0.30, les
équations de Drake (1976) et celles de Hart et Davis (1978) basées
sur le coefficient de partage du Ni (olivine-liquide) aboutissent
à des résultats cohérents entre eux et avec ceux obtenus par les
méthodes précédentes.
Ces géothermomètres ne s'appliquent pas à des roches dont
le rapport Si/0 = 0.30 mais dont les conditions de cristallisation
diffèrent totalement de celles des basaltes, (c'est le cas des
ultrabasites de Arndt).
Il faut aussi souligner que le nickel est un élément en
faible quantité en général, et son dosage, à la microsonde électronique par exemple demande beaucoup de rigueur.
En effet, les erreurs dites systématiques liées à la méthode analytique, ne doivent pas engendrer des écarts de températures
qui pourraient sembler significatifs.
- 45 -
Pour les mêmes types de basaltes que précédemment
et les basaltes andésitiques le géothermomètre de Mathez (1973)
basé sur l'équilibre plagioclese-liquide, donne des températures
proches des résultats connue.
La pression d'eau doit être inférieure à 0.5 Kb.
Les équations de Kudo-Weill(l970), pour des P H20 compatibles
aves les magmas cités ci-dessus, aboutissent à des températures
100°C trop hautes.
En outre la pression d'eau estimée à partir du géobaromètre
des mêmes auteurs est entachée d'une erreur de l'ordre de 1 Kb.
Pour des roches ä orthopyroxène-cllnopyroxène en équilibre,
différentes équations basées sur la ^répartition . de Fe et M g
et Ca entre les deux pyroxenes (Wood-Banno
1973j Saxena-Nehru 1975.
Welles 1977) existent.
Les travaux expérimentaux sur la répartition Fe; Mg et Ca
dans les deux sites des pyroxèens sont encore peu nombreux,
aussi ces géothermomètres sont-ils souvent contreversés.
'Wood et Banno ont appliqué leurs équations à différents types de
roches : péridotites, charnockites, laves.
D'après les exemples que nous avons choisis, les résultats obtenus
par cette méthode, pour des laves de type basaltique, sont
compatibles avec les températures calculées par d'autres méthodes
et proches de ceux de Welles.
La conclusion importante à tirer de ce travail est que
les températures obtenues à partir des divers géothermomètres
exposés, n'ont pas une valeur absolue, mais relative;
Ce qui veut dire que la variation de la température que l'on
constate par les géothermomètres, au cours de l'évolution
d'un magma, est significative, dans la mesure où d'autres
arguments péfcrographiques, géochimiques ou autres vont dans le même
sens.
Du point de vue de la Géothermie :
un changement de température témoigne :
-
de la cristallisation fractionnée, ce qui est intéressant
si le volume.de roches différenciées
par exemple est connu.
- d ' u n e variation de pression de fluides,
liée à une contamination
qui peut être
éventuelle par l'encaissant ou par
un autre magma.
I a température associée à la minéralogie permet ensuite,
à partir des diagramme résiduels d'estimer la pression d'eau
régnant lors de la cristallisation, et de confirmer ainsi la
profondeur de la chambre magmatique, évaluée précédemment par
d'autres méthodes.
- 46 -
C'est ainsi que pour les ponces d'Avellino et de Pompei
(Barberi et Al, 1979) du Mte Sonna-Vesuvius la température minimale
de cristallisation (obtenue par thermométrie optique) des feldspath
alcalins et de la leucite était cohérente avec un fractionnement le
long de la cotectique feldspath leucite dans le système Ks-Ne-Q
(Hamilton Me Kenzie) pour 1 Kb de P H20 (à Avellino) et 1.3 Kb (à
Pompei).
Ces résultats venaient confirmer la profondeur du réservoir
magmatique estimée à 4 km par d'autres méthodes.
De même au Mont Dore, Maury (1976) a pu déterminer les
conditions physiques prévalant dans le réservoir magmatique lors du
fractionnement des roches potassiques intermédiaires (mugéarites, benmoréites).
Pour l'Erta Aie et le Boina en Afar, ainsi que pour la
série d'Asal en République de Djibouti, la même approche a permis
de préciser que la pression à laquelle le magma s'est stabilisé dans
la croûte superficielle était très faible (inférieure à 0,5 Kb) soit
quelques kilomètres tout au plus.
Plus qu'une véritable information quantitative permettant
de fixer en profondeur des objectifs d'intérêts industriels, l'application des géotherxnomètres et gêobaromètres minéraux magmatiques permet de déterminer l'existence d'un fractionnement et de donner un
ordre de grandeur de la pression le caractérisant. Couplée avec d'autres
données volcanologiques et pétrologiques, la méthode permet de préciser la profondeur, l'extension et la persistence de la source de chaleur caractérisant le champ géothermique étudié.
- 47 -
BIBLIOGRAPHIE
Anderson A.T. (1968) The oxygen fugacity of alkaline basalts
and related magmas, Tristan da Cunha. Amer Journ Se
266, p 704-728.
Arndt N.T. (1977) The partioning of nickel between olivine and
ultrabasic and basic komatiite liquids.
Barberi, F
Carnegie Inst. Washington. Year Book 7 6 .
Résumé présenté à Canberra
Benhamou G. (197 6) Etude des conditions de fractionnement de séries
basaltiques et rhyolitiques de l'Afar (Ethiopie).
Thèse 3ème cycle. Orsay.
Bowen N.L.(1913) The melting phenomena of the plagioclase feldspars.
Amer Journ Sei 35, p 577-599.
Bowen N.L. (1915) The crystallization of haplobasaltic haplodioritic and related magmas. Amer Journ Sei 40, p 161-185,
Bowen N.L. and Shairer J.F. (1935) The system MgO-FeO-SiO2.
Amer Journ Sei 29, p 151-217.
Brown F»H. and Carmichael I.S.E. (1971) Quaternary volcanoes
of the lake Rudolf Region. Lithos 4, p 305-323.
Brown W. and Parsons I. (197 8) Les deux géothermomètres à deux
feldspaths. Une critique. 6ème R.A.S.T.
Bryan W.B. (1974) Fe-Mg relationships in sector zoned submarine
basalt plagioclase. Earth Planetary Sei Letters 24,
p 157-165.
Buddington A.F. and Lîndsley H. (1964) Iron titanium oxide
minerals and synthetic equivalents. Journ Petrol 5,
p 310-357.
Carmichael I.S.E. (1967) The iron titanium oxide of salic volcanic
rocks and their associated ferromagnesian silicates.
Contrib Mineral Petrol 14, p 36-64.
Drake M.J. (1975) Plagioclase thermomtry and barometry in ingneous
system. Inter. Conf. on geothermomters and geobarometers
Pensylvany University.
Drake M.J. (1975) The oxidation state of europium as an indicator
of oxygen fugacity. Géochim. Cosmochim. Acta 39, p 55-64.
- 48 -
Drake M.J. and Weill D.F. (1975) Partition of Sr, Ba, Ca, Y, Eu 2+,
Eu3+ and other REE between plagioclase feldspar and
raagmatic liquids : an experimental study.
Geochim. Cosmochim. Acta 39, p 689-712.
Drake M.J. (1976) Plagioclase melt equilibria.
Geochim. Cosmochim Acta 40, p 457-465.
Duke M.J. (1976) Distribution of the period four transition
elements among olivine calcic pyroxene and mafic
silicate liquids : experimental results.
Journ Petrol 17, p 499-522.
Ewart A., Green D.C., Carmichael I.S.E. and Brown F.H. (1971)
Voluminous low temperature rhyolitic magmas of New
Zealand. Contrib Mineral Petrol 33, p 128-145.
Ewart A., Hildreth W., Carmichael I.S.E. (1975) Quaternary acid
magma in New Zealand. Contrib Mineral Petrol 51, p 1-29.
Ewart A. XI976) A petrological study of the younger Tongan and
dacites and the olivine tholeiites of Nua Fo'Ou Island
SW Pacific. Contrib Mineral Petrol 58, p 1-21.
Glitsch L. and Allègre C.J. (1979) Determination of crystallization
temperatures in fractional crystallization series by
Ni partitioning equation. Earth Planetary Sei Letters
44, p 105-118.
Haklî T.A. and Wright T.L. (1967) The fractionation of nickel
between olivine and augite as geothermometer.
Geochim Cosmochim Acta 31, p 377-884.
Haklî T.A. (1968) An attempt to apply the Makaopui nickel
fractionation data to the temperature determination
of a basic intrusive. Geochim Cosmochim Acta 32, p 449-460.
Hart S.R. and Davis K. (1978) Nickel partitioning between olivine
and silicate melt. Earth Planetary Sei Letters 40, p 203-219.
Irvine T.N. and Kushiro I. (1976) Partitioning of nickel and Mg
between olivine <and silicate liquids.
Carnegie Inst. Washington Year Book 75, p 668-675.
Kudo A.M. and weill D.F. (1970) An ingneous plagioclase
geothermometer. Contrib Mineral Petrol 25, p 52-65.
Leeman W.P., Vitaliano C.J., (1976) Petrology of Me Kinney basalt,
Snake River Plain, Idaho. Geol Soc Amer Bull 87,
p 1777-1793.
- 49 Leeman W.P. Scheidegger K.P. (1977) Olivine liquid distribution
coefficients and a test for crystal-liquid equilibrium.
Earth Planetary Sei Letters 35, 247-257.
Leeraan W.P. (1978) Distribution of Mg2+ between olivine and silicate
melt and its implications regarding melt structure.
Geochim Cosmochim Acta 42, p 789-800.
Leeman W.P. and Lindstroxn D.J. (1978) Partitioning of Ni2+ between
basaltic and synthetic melt and olivine.
Geochim Cosmochim Acta 42, p 801-816.
Lindstrom D.J. (197 6) Experimental study of the partitioning of the
transition metals between clinopyroxene and coexisting silicate
melts. PhD Thesis. University of Oregon.
Massare D. (1979) Etude des inclusions vitreuses de quelques minéraux
de roches volcaniques acides : thermométrie optique, barométrie,
compositions chimiques et éléments volatiles dissous. Thèse Orsay.
Mathez E. (1973) Refinement of the Kudo-Weill plagioclase thermometer
Contrib Mineral Petrol 41, 61-72.
Maury R.C. (1976) Contamination et cristallisation fractionnée de séries
volcaniques alcalines continentales (Massif Central) et océaniques
(Pacifique Central). L'origine des laves acides. Thèse Orsay.
Metrich N., Bizouard H., Clocchiatti R. (197 8) Les conditions
physico-chimiques de cristallisation des plagioclases du lac de
lave de l'Erta Aie \Ethiopie)o 6ème RAST.
Muñoz M., Sagredo J. (1974) Clinopyroxene as geobarometric indicators
in mafic and ultramafic rocks from Canary Islands.
Contrib Mineral Petrol 44, p 139-147.
Mysen (1975) Partitioning of iron and magnesium between crystals and
partial melts in peridotite upper mantle.
Contrib Mineral Petrol 52, p 69-77.
Mysen B. (1976) Partitioning of Ni and Mg between upper mantle crystals
and partial melts as a function of pressure, temperature and
nickel concentration.
Carnegie Inst. Washington. Year Book 75, p 662-668.
Mysen B., Kushiro I. (1979) Pressure dépendance of nickel partitioning
between forsterite and aluminous silicate melts.
Earth Planetary Sei Letters 42, p 383-388.
Nehru C.E., Willye P.J. (1974) Electron microprobe measurement of
pyroxene coexisting with H20 undersaturated liquid in the join
CaMgSi2O6-Mg2Si2O6-H2O at 30 Kb with application to
geothermometry. Contrib Mineral Petrol 48, p 221-228.
- 50 -
Neumann H., Mead J., Vitaliano C. J. (1954) Trace element
variation during fractional crystallization as
calculated from distribution law.
Geochiin Cosmochim Acta 6, p 90-99.
Neumann E.R. (1974) The distribution of Mn2+, Fe2+ between ilmenite
and magnetite in ingneous rocks. Amer Journ Sei
274, p 1074-1088.
Neumann E.R. (1976) Composition relations among pyroxenes,
amphiboles and other mafic phases in Oslo region
plutonio rocks.Lithos 9, p 85-111.
Powell M. and Powell R. (1974) An olivine clinopyroxene
geothermometer. Contrib Mineral Petrol 48, p 249-263.
Powell M. and Powell R. (1977) Geothermometry and oxygen barometry
using coexisting iron titanium oxides : a reappraisal.
Mineral Mag 41, p 257-263.
Powell M. and Powell R. (1977) Plagioclase alkali felsdpar
geothermometry revisited. Mineral Mag 41, p 253-256.
Prince A.T. (1943) The system albite-anorthite-sphene. Journ Geol
75, p 126-140.
Provost A. and Allègre C.J. (1979) Process identification and search
for optimal différenciation parameters from major
element data. General presentation with emphasis on the
fractional crystallization process.
Geochim Cosmechim Acta 43, p 487-501.
Roeder P.L. and Emslie R.F. (1979) Olivine liquid equilibrium.
Contrib Mineral Petrol 29, p 275-288.
Roeder P.L. (1974) Activity of iron and olivine solubility in
basaltic liquids. Earth Planetary Sei Letters 23,
p 397-420.
Roux J. (1979) Etudes physicochimiques des feldspathoides et
application aux problèmes pétrographiques. Thèse de
doctorat d'état, Université Paris Sud, p 53.
Ross M. Huebner J.S. (1975) A pyroxene geothermometer based on the
composition - temperature relationships of naturally
occuring orthopyroxene-pigeonite-augite.
Intern. Conf. on geothermometers and geobarometers.
Pensylvany university.
Saxena S.K., Nehru C.E. (1975) Enstatite-diqpside solvus and
geothermometry. Contrib Mineral Petrol 49, p 259-267.
Saxena S.K. (1976) Two pyroxene geothermometers : an approximative
solution. Amer Mineral 61, p 643-652.
*
- 51 -
Speidel D.H. (1970) Effect of magnesium on the iron titanium oxides.
Amer Journ Sei 268, p 341-354.
Stormer J.C. (1975) A practical two feldspar geothermometer.
Amer Mineral 60, p SS7-674.
Sun C O . , Williams R.J., Shun S.S. (1974) Distribution coefficient
of Eu and Sr for piagioclase-liquid and clinopyroxeneliquid equilibria in oceanic ridge basalts : an
experimental study. Geochim Cosmocliim Acta 38,
p 1415-1435.
Takahashi E. (1978) Partitioning of NÍ2+, Co2+, Fe2+, Mn2+ and Mg2+
between olivine and silicate melts. Compositional
dépendance of partition coefficient.
Geochim Cosmochim Acta 42, p 1829-1844.
Watson E.B. (1977) Partitioning of Mn between forsterite and
silicate liquid. Geochim Cosmochim Acta 41, p 1363-1375.
Wells R.A. (1977) Pyroxene thermometry in simple and complex
systems. Contrib Mineral Petrol 22, p 129-139.
Withney J.A. and Stormer J.C. (1977) t!wo feldspar geothermometer
geobarometer in mezozonal granitic intrusion.;7;
Contrib Mineral Petrol 63, p 51-64.
Wones D.R. and Eugster H. P. (1965) Stability of the biotite :
experiments, theory and application.
Amer Mineral 50, p 1228-1269.
Wones D.R. (1972) Stability of the biotite : a reply .
Amer Minerai 57, p 316-318.
Wood B.J. and Carmichael I.S.E. (1973) P total, P H20 and the
occurence of cummingtonite in volcanic rocks.
Contrib Miner1 Petrol 40, p 149-159.
Wood B.J 3nd Banno S. (1973) Garnet orthopyroxene and orthopyroxene
clinopyroxene relationships in simple and complex
systems. Contrib Mineral Petrol 42, p 109-124.
Wood B. (1976) An olivine clinopyroxene geothermometer.
Contr Mineral Petrol 56, p 297-303.
Yoder H.S., Stewart D.B. and Smith J.R. (1957) Ternary feldspar.
Carnegie Inst. Washington. Year Book 56, p 206-214.
A N N E X E
(références des -programmes correspondant aux numéros des chapitres du texte)
User Instructions
Program Description
Program Title
_
S
Date
Name
Address
City ._
cu.
_
Zip Code
State
_.. . . .
Program Description, Equations, Variables, etc. _
A A
... Vt-^Jjx,. x tCü
-—
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
>•
A ^\~
J>
\
A'Í
V-r
Ffe^O^. .-tTuFec,..
^
OUTPUT
DATA/UNITS
KEYS
Til
I
ku-fvtrt / . ? ,
T"tt F o » f)>
IH f Fe. 0 \
T>r
_M
\ Hr'T'r-
3t-
(')
AUfa.
1 '
> F?
¿*C\ ,-i ù/ri \ o i^-V" U x c m e f n V L C tt.i
Y\<rr\e- Cr.
•
.
. ..... ...
.
Í- u \ Kf f
> m flrui
;\i\
i \ \tX(
\^A
if-
H ..o
-
t-
K^
TY F^
h.O•
C&tf):
E Z H - ^ n.../
~ -> H
-
-
-
-
Lyoi'p Li
Operating Limits and Warnings
_
-
.
"
.
.
.
.
--
—
.
"
"
-
'
—
cm
LZU
Ci!
Ci)
User Instructions
Program Description
(II.1.2.)
«. _
Program Title
Name
3 zx
ZeWeAA
j¿,v
^-k-^J<L M . . .
. ._ .
- ^ M rT- •
Date _...
-
Address
State
City
.. Zip Code
Program Description, Equations, Variables, etc. .__
....
.
-
_
- -
U
.i^u
lOf
«.K'X-V'1-UW
/
Lu. a i
y-}
X [
V o* i/;.!^ ù-
U^vUX? ^-< /
/b~- V
Vuf,.'
Y
i!r x H ».
01 fü Lvx
LZZ1
. ...
\ * "
VAi^kVö
u
"*%
-
3 cm
—
..
- -
OUTPUT
DATA/UNITS
KEYS
•¿
At-. \r r\jJ>iC_\,-Qi,uu
/- |«.
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
HA
l\ "\AAj!klA_
.-r
3*-
__ ...
,o..
0,-.
°^ \ tx^.\ rl 9-, la
.Operating Limits and Warnings
-
•—
—... ..
.
X1
•
czi
cmizzi
i
ir~i
i
M
i
n
DO NOT USE THIS SPACE
CP
' er.a\ V
v-r to. w^>
CZH
i
User Instructions
Program Description
en.2.1.)
Program Title __6- &o Y W?t- W o UAA VU? . _ £? \ ¿cu LO C ICWÍ«. Name
_ ^ ^ „ . „ V t I LL
Address
City
.
.._
.
Date
.
,
....
.
" -s
_
.
._
State
Zip Code
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
Program Description, Equations, Variables, etc.
A
^¿A-e.
OUTPUT
DATA/UNITS
KEYS
0V WAVO.
i»
g TV/ I
fl /
n r.
A
Y
.A.---
y cuxiti >
\.
IUÍL
P Ol .
A-ÏVJ
X
n
-> A
f?, / _ S
LZZ1
— ^ T°C fli'uc-
[ZU
T° r a
ai v
—> T
7°
_G^^'
I
II I
I
II
IZZIIZZ1QX.M
' O n . A~i.<iLt.<
I
ÍJIÁJ
dHIZZI
7
I
A3-
II I
LZZIIZZI
•"7
Operating Limits and Warnings
LZZI
JCL
A/J
—
T°r
•S T V
a
ft'yí
7-0
LZZ1
czu
czn
Program Description
User Instructions
•
/
-
4
Program Title
Name
(II.2.2.)
Mf
Date
Ö
Address
State
City
Zip Code
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
Program Description, Equations, Variables, etc.
HZ)
Im
Kin, p Uñ
V
C/^ n
(
7?/o L
/-¡It
ur-u t
"i #"*. /"
i / -\
TV^1^^
y , \-
i
/
e
'is-.jt,y-+L,£'(j'ij.io' A- !-¿i.i
( K . j lo" >3^ /
X-el
. X ¿ t " / - X f t Pic
Ö/ Kb
-li.
. -gp^a-C Vue iA (UX-
I
x^^5 . 'Tprio /
rr~
YA-..'
L (^ <j u . - r I in
(Lw%.
.,h
OUTPUT
DATA/UNITS
KEYS
JI fri,r
(M
PL.
_A
Áíjiir\,'.o
V -
ac
rl I
•i
E . A . Mathez:
Opei
î"ig. '.i. Comparison of values of ;'\1I/('AII a s â
funrtion of piacioclasf coinposit ion cale iilnted
for Ihcd.-tj ofTalilo:?.ii<injiE'|.(G,>nnH7'(iXp,
«it!i tlu> data of Orvillc (1972, p. 2o5)
Ö'
ñ A'
I
Program Description
Program Title
Name
Q zo \\jux.
-q
ruL
-
«JC W - J -
-\
CUM.C;
Address
User Instructions
S U M .
e n . 2.3.3
l"_¿? W - A - ^
Date
W \ " U UXCM. <! -
City
Zip Code
State
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
KEYS
OUTPUT
DATA/UNITS
Program Description, Equations, Variables, etc.
C&-[ZUL\
—¿i«-
- &' K%
les- . "Hi Wc
^^
_T"> h lai^-nf L
TTV . r s •« |)0
^
. / > . r"
•
i
i
W3U*J
i
\
m
- -
U Ho
I
L
-
/^L-
.
^
.. J/öolf
<^C\J ^ - ^ ' ' Z . -
'
1p l o - ö v^a <L
x- \rCuu v Í
I ,^i A . UA^
-+--
ena..
|_.I_
.A"
I Pi J.I
( A
S*\j>
/ > w JUO\
I
ic
ÜJ
JU-K0I
u u-<
«_ C
1
Jl
, 1
I
LZZI
(
Operating Limits and Warnings
LZH
LZU
User Instructions
Program Description
r
A+
Program Title
CWcO i ocU-SrO -
3 ^>^V { '
Date
Name
(II.2.4.)
Address
Zip Code
State
City
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
KEYS
OUTPUT
DATA/UNITS
Program Description, Equations, Variables, etc.
y
le.
Ao U f.
-rv-Ctv
SXJJ e r
LZZI
C rx.
Cu
Ulu.fi
P. \ , >
{&)
II
I
^¿;\
^., ,
T°
UA.ÍO ,'
"t
¿a.
I f^L I
fi-
\AI
\.Di
tr-.
\-L\jt
CIJL! n
LZZl
r
\;
UJS
tZZl
'" 1°«
uuj
(+
£
M
T? * K ( M
LZH
. ll Hf LQ \ \
A -
ft
- - A -C
/ ? q L ij
...; o.
cm
£.
±£ü
-M
LZZI
Operating Limits and Warnings
k-'
czi-
Î*-.
•
;
.
User Instructions
Program Description
Program Title Q (uo " V U M _ vue VMJ4TJZ_
Name '3)vo~VJ- _J*\~\~i —
uût
I
Date
Address
City
State
Zip Code
INSTRUCTIONS
STEP
Program Description, Equations, Variables, etc..
_i_<viuk ^_La>_
. T0^- -
C.\ 8-0
/
(II.2.5.)
?-^\
L*t K . +.<
INPUT
DATA/UNITS
KEYS
OUTPUT
DATA/UNITS
^ Á.
aD UQ
7T
..._„(*__-. ... A A b - / - - . .
/
-^. • i > « J ,
'
. • : - - : _ .
LZZI
. . . .
— ......
. ,_
_ ..
. .._
T°C—
.
_.
.........
.
I
-.
-
-
LZZI
•
-
.
.
II I
.
LZH
—
-
-
—
•
-
Operating Limits and Warnings
•
cm
DO NOT USE THIS SPACE
User Instructions
Program Description
(II.3.1.)
S
Program Title
pou
Name
Date
Address
City
Zip Code
State
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
Program Description, Equations, Variables, etc.
KEYS
OUTPUT
DATA/UNITS
,- ( V&A • íx^j^l,.^--
LTU.V K ^ V - 1 / I X W /
L a --Tivn. C V> *>>^
liiiilftiK
<4 A - U C \ <.
-V
-—-<-
>c rt-in e v
uHOii \l i.
x-i
XAF-,£L
Xftk
1
'\/h\/>iik<í
Wot vi <: ^
u ),!
p vojEi Co
P
i
-
c njM
T -\ !••> fl
VAAjAñixj
J
rt
H
Ö L
<iA
IJ 0.1,
X
T. C JSL
. . .
_ XK ; AF. r
eu
tía
ftf
- \ -^iU
O TO
hl
•
"
"
-
-
U i J ko hin,
-
\
f
i.
•
¿Ha i
.'.
. .
PiV>— c u ex On. _>:
~Íh*O.C. V t C \
. CJU-_—UJO.U
•
......
LZZI
- .-
-
-
LZZ]
Operating Limits and Warnings
-
. .•
. . . . . .
CZZI
DO NOT USE THIS SPACE
EU]
LZZI
LZZI
User Instructions
Program Description
Program Title
¿^ ei U A . M U Í
(II.4.1 - II.4.2. •
II.4.3. - II.4.4.)
.
Q
Date
Name
m
Address
State
City
Zip Code
Program Description, Equations, Variables, etc.
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
OUTPUT
DATA/UNITS
KEYS
^nní7
/\rtO\3
o-f
AH^ O
¿L
V
s
iKi^oj
1 kcFeo\ —
n,\
At
rt olu/
Ln TfiiAjjLn \TTA 0. durer, r
Han
m
14«
\- p
J 9i7
/
I1e - I - •
izziczn
prni
LJ
I
AVi^o
.. . .
i<!vof\lfi> \. Í n\iJL0 ÏVJZ.
i
NLÍÍ U i n u .
ol\V
C|P l^n
V(u/) n\\AJ
n
fvn*
•
-
;
-
;
•
;
:
;
:
^
-
Operating Limits and Warnings
^
^
*
"
'
'
j
a
r
:
'
;
;
:
>T>. f
r^/-i nV
:
.
-
à
Fürt *i
rv/,0
? ^ If
Pa
\ c
•muz:
A
-
l/\"%
ni^A
Uri^.Ay
User Instructions
Program Description
^1
Program Title
Name
(II.6.1. - II.6.3. II.6.4)
vM
1 VvToooji -
Date
Address
City
State
""' •
Zip Code
INPUT
DATA/UNITS
INSTRUCTIONS
STEP
Program Description, Equations, Variables, etc.
OUTPUT
DATA/UNITS
W
iHA
A.
KEYS
Ae l oV-<Ol
4
i \ru j
f
by
F. Vh
3+-
LUD
VC
-
. < « * •
t
"
RU
H¿
HI
«t
-i
y
TL
T°r. w e \
Operating Limits and Warnings
?
i*.b
îl.
^>
y
Lzzr
fil
It(T •»r f u / i iTo
DO NOT USE THIS SPACE
u
User Instructions
Program Description
-1
(II.7.1.)
Powell «> £ouM\ -
Program Title
Name
Date
PI i
Address
State
City
Zip Code
Program
gra Description, Equations, Variables, etc.
Q
1
CXJL Z
o. oi+sr f P
f ^ 0 e W -t- 3-6
.
R,
L-
I/Vf
Vn .\ \f4-
.._
/ H V/AA-L\«_
'. À
CAS.
S
(¿jt^<a >
V U kT V L / J L ^ I
KEYS
-^~At 1 ^ ~ -
UJl
\
(V
^
V
r~ep -feV" -PJA. A
IA I T J
KJL
.T
^^rrf
(-ñ . F ^
FO
I .-n^i
liAi
P7
>T?\K
O n Vart^-^
,0 Wr.O VULJUL J).tJr fíu ° VI
EH]
IZZI
IZZI
Operating Limits and Warnings
LZZI
czn
DO NOT USE THIS SPACE
OUTPUT
DATA/UNITS
EZHCZD
\ o i i \<3 \ixS. U .
><tA / / >
fa
*/.
INPUT
DATA/UNITS
INSTRUCTIONS
STEP