SNP – 26.01.17 – 8h à 9h – Maladie de Parkinson

SYSTEME NEUROSENSORIEL ET PSYCHIATRIE – Maladie de Parkinson : physiopathologie et bases pharmacologiques
1/14
26/01/2017 8h-9h
MUSOLES Axel D1
CR : PAYRASTRE Clémentine
SNP
Pr. A. Eusebio
14 pages
Maladie de Parkinson : physiopathologie et bases pharmacologiques
Plan
A. Physiopathologie
I. Historique
II. Épidémiologie
III. Les noyaux gris centraux
IV. Le système dopaminergique
V. Subdivision fonctionnelle des ganglions de la base
VI. Mécanisme de mort neuronale
VII. Physiopathologie
VIII. Origine polyfactorielle
B. Bases pharmacologiques
I. Antiparkinsoniens
II. Traitement chirurgical
MP = Maladie de Parkinson.
A. Physiopathologie
I. Historique
– 1817 : La maladie de Parkinson a été décrite par James Parkinson comme une paralysie agitante.
– 1912 : Lewy décrit des anomalies histologiques, sous forme d’inclusions cytoplasmiques dans les
neurones, qui portent son nom : les corps de Lewy (pas encore de lien avec la maladie de Parkinson)
– 1919 : Trétiakoff montre que les lésions responsables de la MP (Maladie de Parkinson) sont les corps de
LEWY que l'on retrouve principalement dans locus niger (substance noire) avec une perte sélective des
neurones de la substance noire → pas encore de lien avec le déficit en dopamine
– 1960-1965 : Mise en évidence d'un déficit en dopamine chez les parkinsoniens en lien avec les neurones
dopaminergiques perdus
– 1960-1970 : Identification de la voie dopaminergique nigrostriée, c'est-à-dire les neurones
dopaminergiques qui partent de la substance noire et qui vont jusqu'au striatum
– 1970 : 1ère utilisation de la Lévodopa (précurseur de la dopamine), qui améliore les symptômes de la MP
– 1975 : 1ère utilisation d'un agoniste dopaminergique (Bromocriptine)
– 1982 : MPTP (1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine) : est un neurotoxique découvert par hasard,
qui permet de recréer artificiellement les lésions de la voie dopaminergique nigrostriée, et donc de créer
des modèles animaux de la MP, ce qui a permis le développement de recherches thérapeutiques et
cliniques dans le cadre de la MP.
– 1986 : Début de la stimulation cérébrale profonde pour traiter les symptômes de la MP, technique
découverte par un neurochirurgien français.

SYSTEME NEUROSENSORIEL ET PSYCHIATRIE – Maladie de Parkinson : physiopathologie et bases pharmacologiques
2/14
II. Épidémiologie
La maladie de Parkinson concerne entre 150 000 et 200 000 personnes en France.
Sa prévalence est de 2/1000 personnes.
C'est la 2ème maladie neurodégénérative, après la maladie d'Alzheimer (environ 800 000 patients en France).
Incidence d'environ 8000 nouveaux cas par an (soit 15/100 000), donc maladie assez fréquente.
Elle a une discrète prévalence masculine, et l'incidence augmente avec l'âge, avec 4/1000 entre 65 et 75 ans, et
4,7% entre 75 et 85 ans.
L'âge de début « classique » est entre 60-65 ans, et lorsqu'on développe une MP après 75 ans, on parle de MP
du sujet âgé.
Quand la maladie débute après 60 ans, elle a peu d'impact sur l'espérance de vie puisque la durée d'évolution
moyenne est de 18 ans.
III. Les noyaux gris centraux
Les noyaux gris centraux sont situés en profondeur dans le SNC et on les appelle aussi les ganglions de la base.
Ce sont des noyaux de substance grise situés dans la substance blanche autour des ventricules du cerveau, et sont
constitués de plusieurs noyaux qui sont pour la plupart pairs et symétriques. Ces noyaux gris centraux sont :
– le noyau caudé
– le putamen
– le pallidum, qui est coupé en deux parties : le pallidum interne et le pallidum externe (on parle aussi de
globus pallidum, et de GPI : Globus Pallidum Interne et de GPE : Globus Pallidum Externe)
– le noyau sous-thalamique (NST)
– la substance noire
Le thalamus ne fait pas partie des ganglions de la base, il fait juste office de sortie.
Le striatum correspond à l'association du striatum dorsal et du striatum ventral :
– le striatum dorsal correspond à l'association noyau caudé + putamen
– le striatum ventral correspond à l'association noyau accumbens + tubercule olfactif.
Le striatum est donc composé de 4 parties : le noyau caudé, le putamen, le noyau accumbens et le tubercule
olfactif, mais quand on parle de striatum, en général, on parle du noyau caudé et du putamen.
La voie nigrostriée est la voie des neurones dont le corps cellulaire se situe dans le locus niger et qui envoient
des axones jusque dans le striatum, c'est-à-dire jusque dans le putamen et dans le noyau caudé.
Ce sont les neurones de cette voie nigrostriée qui synthétisent la dopamine.

SYSTEME NEUROSENSORIEL ET PSYCHIATRIE – Maladie de Parkinson : physiopathologie et bases pharmacologiques
3/14
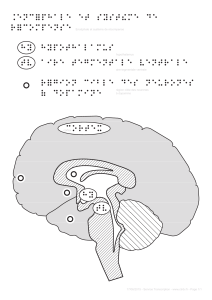
IV. Le système dopaminergique
Flèche bleue = inhibition, flèche rouge = excitation
Les ganglions de la base sont organisés de façon fonctionnelle, par le biais d’un certain nombre de connexions
Le cortex représente l’essentiel des points d’entrée dans les ganglions de la base, et le thalamus est l’essentiel
des voies de sortie, il a un rôle excitateur sur le cortex moteur, et va améliorer la motricité et permettre le
mouvement volontaire.
Le GPI (Globus Pallidum Interne) a un effet inhibiteur sur le thalamus, et le NST (Noyau Sous-Thalamique) a
un effet inhibiteur sur le GPI.
A l'état physiologique :
La substance noire (qui se divise en deux parties : la pars compacta et la pars reticulata ; et ce sont surtout les
neurones de la pars compacta qui sont dénervés dans la maladie de Parkinson) envoie des neurones
dopaminergiques sur le striatum : c'est la voie nigrostriée.
Au niveau du striatum, il existe deux types de récepteurs dopaminergiques : les récepteurs D1 et D2. CR : Il y a
donc deux modes de connexion jusqu’au GPI :
– Lorsque la dopamine active les récepteurs D1, on parle d'activation directe de la voie dopaminergique.
Les récepteurs D1 sont activés par la dopamine au niveau du striatum, ils activent la voie directe, et il y a
Cortex
Striatum
D2 D1
STN
GPe
SNc
Thalamus
GPi
/
SNr
excitation
inhibition
Voie indirecte
Voie directe
Mouvement
Albin et al, 1989
DeLong
, 1990

SYSTEME NEUROSENSORIEL ET PSYCHIATRIE – Maladie de Parkinson : physiopathologie et bases pharmacologiques
4/14
donc une activation du thalamus par le GPI, ce qui active le cortex. Ceci permet donc le mouvement
volontaire. CR : on a une inhibition du GPI par le striatum, le GPI inhibant lui-même le thalamus, cela
aboutit à une activation du cortex. C’est la voie entre le striatum et le GPI qui est considérée comme
directe.
– Lorsque la dopamine active les récepteurs D2, on parle d'activation indirecte de la voie dopaminergique.
Il y a inhibition du GPE (Globus Pallidum Externe), or ce GPE inhibe le NST. Il en résulte une excitation
de ce NST (puisqu'on inhibe un inhibiteur, « moins par moins ça fait plus » ...) qui va permettre l'excitation
de l’association substance noire/GPI, donc une inhibition du thalamus et donc du cortex.
En résumé :
La voie directe permet la réalisation du mouvement volontaire par excitation du thalamus puis du cortex
moteur, alors que la voie indirecte est inhibitrice des mouvements parasites.
A l'état pathologique :
A l'état pathologique, il y a une perte des neurones de la pars compacta de la substance noire.
– Par la voie directe : il y a moins d'excitation de la voie directe (récepteurs D1), et donc moins d'excitation
du thalamus, et donc moins d'activation du cortex cérébral par la voie directe, ce qui fait qu'il y a une perte
du mouvement volontaire et donc ceci explique le ralentissement moteur dans la maladie de Parkinson
(bradykinésie). → moins d'activation du cortex moteur.
Cortex
Striatum
D2 D1
STN
GPe
SNc
Thalamus
GPi
/
SNr
Mouvement
Albin et al, 1989
DeLong
, 1990

SYSTEME NEUROSENSORIEL ET PSYCHIATRIE – Maladie de Parkinson : physiopathologie et bases pharmacologiques
5/14
– Par la voie indirecte : il y a moins d'activation des récepteurs D2. Or, ces récepteurs D2 inhibent le GPE.
Le GPE est donc moins inhibé dans le cadre pathologique. Comme ce GPE est moins inhibé, il va ainsi
plus exercer sa fonction inhibitrice du NST : le GPE inhibe donc moins le NST. Il y a alors, in fine, moins
d'activation du cortex moteur par cette voie indirecte.
Par ailleurs, il faut savoir que ce NST a pour rôle d'inhiber les mouvements involontaires qui viennent
parasiter les mouvements volontaires. Dans le cadre de la maladie de Parkinson, comme il y a une perte
de cette inhibition des mouvements involontaires par le NST, il en résulte une apparition de tremblements
de repos.
En résumé :
- En situation physiologique :
• La voie directe active le mouvement volontaire
• La voie indirecte inhibe les mouvements parasites, permettant la réalisation d'un mouvement
homogène et précis.
- En situation pathologique :
• La perte d'activation de la voie directe diminue l'activation du cortex moteur
• La perte d'inhibition de la voie indirecte entraîne l'apparition des mouvements parasites, comme
le tremblement de repos dans la maladie de Parkinson.
Dans la maladie de Parkinson, il y a donc une perte des neurones de la substance noire, et donc une diminution
de l'activation dopaminergique sur le striatum, ce qui explique en partie la symptomatologie observée.
V. Subdivision fonctionnelle des ganglions de la base
Ne pas retenir la partie basse de ce schéma
Il y a 3 territoires et 5 circuits.
Le cortex se divise en trois parties : le cortex sensori-moteur contrôlant les sensibilités et le mouvement, le
cortex associatif et le cortex limbique qui contrôle les émotions et la réflexion.
Cette subdivision s'applique aussi aux ganglions de la base. Donc, même un petit noyau comme le NST est
subdivisé en un territoire sensori-moteur, un territoire associatif et un territoire limbique.
Le territoire sensori-moteur correspond aux aires motrices primaires et secondaires, et aussi les aires du contrôle
de l'oculomotricité.
Pour ces 3 grandes fonctions du cortex, il va y avoir une organisation différente, ségrégée, qui permet de garder
une certaine différenciation du type d’information qui chemine dans ces structures.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%