Correction du DM n°2 - PCSI CPGE Brizeux 2009/2010

DM n°2 – Architecture de la matière
1
DM n°2
Architecture de la matière
CORRECTION
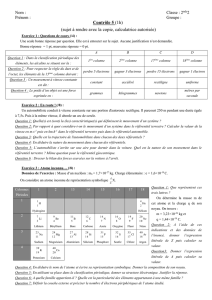
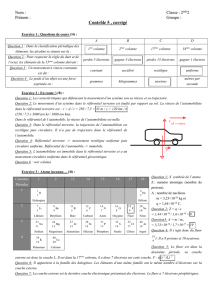
Jeu de piste dans la classification périodique
N°
Indication
Identification
Justification
1 Est utilisé dans la définition de la seconde. Cs
La seconde est la durée de 9 192 631 770
périodes de la radiation correspondant à la
transition entre les niveaux hyperfins F=3 et F=4
de l’état fondamental
6
S
½
de l’atome de césium
133.
2 Est le métal du bloc p de plus petit Z. Al Les éléments du bloc p de Z<13 ne sont pas
des métaux.
3 3
3+
est un ion hydrogénoïde, c’est-à-dire qu’il
possède autant d’électrons que l’atome
d’hydrogène.
Be Be possède 4 électrons, donc Be
3+
n’en
possède qu’un.
4 Est un gaz radioactif dont il convient de se
protéger en aérant bien sa maison. Rn Le radon est souvent présent dans les
habitations peu ventilées ou construites sur
des sols à fort dégagement de radon. Il est
source de cancer du poumon
5 Est le lanthanide ayant même nombre d’électrons
de valence que 6. Gd Il est donc au-dessus de 6, qui est l’actinide
de même configuration électronique de
valence.
6 Est nommé en l’honneur de la seule personne
ayant reçu un prix Nobel de chimie et un prix
Nobel de physique
Cm C’est le curium, nommé en l’honneur de
Marie Curie.
7 Est l’élément ayant l’énergie de première
ionisation la plus élevée. He L’énergie d’ionisation croît de gauche à
droite et de bas en haut dans la
classification, donc l’élément ayant l’énergie
d’ionisation la plus élevée est en haut à
droite.
8 Est l’élément de la deuxième période ne possédant,
dans son état fondamental, qu’un électron p. B Configuration électronique à l’état
fondamental : 1s
2
2s
2
2p
1
.
9 Est l’élément radioactif de Z le plus faible. Tc Premier élément ne comportant aucun
isotope stable.
10 Constitue le diamant. C Le diamant est un empilement organisé
d’atomes de carbone. (Voir futur cours de
cristallographie.)
11 Métal de point de fusion le plus haut. W T
f
= 3695 K
12 Possède 8 protons de moins que 21. Sc Se situe donc 8 cases avant 21.
13 Possède deux électrons célibataires, est dans la
même ligne que 37 et que 48 et Z(13)<Z(37). Si Par élimination. 48 faisant partie des 3
éléments les plus électronégatifs, 13, 37 et
48 sont tous soit dans la deuxième ligne, soit
dans la troisième. Les colonnes
correspondant aux éléments possédant 2
électrons célibataires sont les colonnes 4, 10
14 et 16. Parmi la ligne 2 et la ligne 3, seule
la ligne 3 possède des cases encore vacantes
dans les colonnes 14 et 16 à l’issue d’un
premier tour d’attribution. Donc 13 est dans
la colonne 14, ligne 3 et 37 est dans la
colonne 16, ligne 3.
14 Possède des isotopes appelés deutérium et tritium. H C’est l’hydrogène. (Outre le proton, il y a un
neutron dans le noyau du deutérium et deux
dans le tritium.)
15 Fait partie des trois éléments les plus
électronégatifs et n’est pas dans la même colonne
que les deux autres.
O Les trois éléments les plus électronégatifs
sont F, O et Cl (en haut à droite, gaz rares
exclus).

DM n°2 – Architecture de la matière
2
16 Est le gaz rare de la période de 28. Xe Ligne 5 et colonne 18, c’est le xénon.
17 Elément solide le moins dense existant. Elément
très utilisé dans la fabrication de batteries. Li Ligne 2 et colonne 1, c’est le lithium.
18 Métal du bloc p appartenant à la même famille que
10 et dont le n
max
est 5. Sn Même famille que 10, donc colonne 14 et
n
max
= 5, donc ligne 5.
19 Forme une molécule diatomique qui est (à
température ambiante et pression atmosphérique)
un liquide orange très toxique.
Br La molécule en question est le dibrome Br
2
.
20 Est l’alcalin de la 5
ème
période. Rb Les alcalins occupent la première colonne.
21 Cu
22 Ag
23
Famille de métaux de transition connus depuis
d’Antiquité. Z(21)<Z(22)<Z(23) Au
C’est le seul groupe dont les 3 métaux de
transition sont connus depuis l’Antiquité.
24 Est l’élément le moins électronégatif de la colonne
dont l’électronégativité moyenne est la plus élevée. At La colonne dont l’électronégativité moyenne
est la plus élevée est la colonne 17.
25 Est nommé en l’honneur d’un grand physicien
nucléaire italien du XX
ème
siècle. Fm Le fermium, nommé en l’honneur d’Enrico
Fermi (1901-1954).
26 Est un métal du groupe p très ductile connu depuis
l’Antiquité. Pb Ligne 6 et colonne 14, c’est le plomb.
27 Est l’élément naturel de Z le plus grand. U Tous les transuraniens sont artificiels.
28 28
2+
est isoélectronique
1
de 20. Y Lorsque l’on enlève 2 électrons à l’yttrium
(Z=39), il lui reste le même nombre
d’électrons qu’au rubidium (Z=37).
29 29
3-
est isoélectronique de 20. Se Lorsque l’on ajoute 3 électrons au sélénium
(Z=34), il a alors reste le même nombre
d’électrons que le rubidium (Z=37).
30 Est un alcalin. Na Par élimination car c’est le seul alcalin non
attribué.
31 Est l’alcalino-terreux de la 4
ème
période. Ca Les alcalino-terreux occupent la deuxième
colonne.
32 Z(32)=Z(27)+2. Pu Deux cases après l’uranium.
33 Possède 3 électrons célibataires et Z(33)<18. P Z(33)<18 : il fait donc partie des trois
premières lignes. De plus, il possède 3
électrons célibataires, donc appartient à la
15
ème
colonne. Par élimination (N pouvant
être placé directement), c’est le phosphore.
34 Est un alcalin radioactif. Fr Il n’y a qu’un alcalin radioactif.
35 Est un alcalino-terreux radioactif. Ra Il n’y a qu’un alcalino-terreux radioactif.
36 Fait partie d’une famille connue pour son inertie
chimique et possède une sous-couche d totalement
remplie.
Kr C’est donc un gaz rare appartenant à la ligne
4 ou 5 ou 6. Par élimination (le xénon et le
radon sont déjà attribués), c’est le krypton.
37 Possède 2 électrons célibataires. S Cf n°13
38 Est un métal très fortement réducteur de la même
période que 12. K Les alcalins et les alcalino-terreux sont très
réducteurs car acquièrent la structure
électronique d’un gaz rare en perdant un ou
deux électrons. Dans la période de 12 (4
ème
),
l’alcalino-terreux étant déjà attribué, c’est
donc l’alcalin.
39 La Le lanthane donne leur nom aux lanthanides.
40 Donnent leur nom aux groupes de 14 éléments qui
leur succèdent. Z(39)<Z(40) Ac L’actinium donne leur nom aux actinides.
41 Zn
42 Cd
43
Sont des métaux du bloc d qui ont toutes leurs
sous-couches remplies. Z(41)<Z(42)<Z(43) Hg
En effet, on termine de compléter une
couche nd dans la colonne 12.
44 A pour configuration électronique de valence 5s
2
5p
5
. I Donc ligne 5 et avant dernière colonne du
bloc p, soit colonne 17.
45 Forme (à température ambiante et pression N Seuls N, O, F et Cl forment des gaz
1
Isoélectronique signifie qu’il a le même nombre d’électrons.

DM n°2 – Architecture de la matière
3
atmosphérique) un gaz diatomique
homonucléaire
2
.
A un spin total S = 3/2.
diatomiques mononucléaires à température
ambiante et pression atmosphérique. Parmi
ces atomes, seul N a un spin de 3/2.
46 Forme (à température ambiante et pression
atmosphérique) un gaz diatomique homonucléaire
extrêmement réactif et très toxique. A un spin total
S = 1/2.
F Seuls N, O, F et Cl forment des gaz
diatomiques mononucléaires à température
ambiante et pression atmosphérique. Parmi
ces atomes, Cl et F ont un spin de 1/2. C’est
le fluor par élimination car 48 doit être dans
la même ligne que 13 et 37, 48 est donc le
chlore.
47 Est un métal de transition de la même période que
19 ayant 4 électrons célibataires. Fe Dans la 4
ème
période, seul le fer possède 4
électrons célibataires. (Le chrome fait
exception à la règle de Klechkowsky et en
possède 6.)
48 Fait partie des 3 éléments les plus électronégatifs. Cl Cf 46.
49 Est l’élément du bloc p ayant 3 électrons
célibataires de plus faible énergie d’ionisation. Bi Dans le bloc p, seuls les éléments de la 15
ème
colonne ont 3 électrons célibataires. Dans
une colonne, c’est l’élément le plus bas qui à
l’énergie d’ionisation la plus faible, donc 49
se situe ligne 6 et colonne 15, c’est le
bismuth.
50 Acquiert la structure électronique d’un gaz rare en
perdant 2 électrons et fait partie d’une période
comportant 8 éléments.
Mg Acquiert la structure électronique d’un gaz
rare en perdant 2 électrons, donc c’est un
alcalino-terreux. Il fait partie d’une période
comportant 8 éléments, donc la 2
ème
ou la
3
ème
. Le béryllium étant déjà placé, il s’agit
du magnésium.
14
7
17
3 8 10
45
15
46
30
50
2 13
33
37
48
38
31
12
47
21
41
29
19
36
20
28
9 22
42
18
44
16
1 39
11
23
43
26
49
24
4
34
35
40
5
27
32
6 25
2
Diatomique homonucléaire : ayant deux atomes identiques. C’est donc une molécule de type A-A (ou A
2
).
1
/
3
100%