act3.1 - modeles_histoire _correction

Seconde – Sciences Physiques et Chimiques Activité 3.1
1ère Partie : L’Univers – Chapitre 3 Correction
1
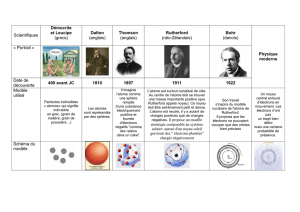
Le modèle de l’atome à travers le temps (correction)
Cela dit, cet atome n’est probablement pas visible… et cette théorie atomistique, rencontrée aussi
chez Empédocle ou Leucippe, aura bien du mal à survivre à leurs audacieux auteurs. L’atome tombe
dans l’oubli, un oubli « orchestré ».
En effet, les idées d’Aristote – et notamment la théorie des
quatre éléments – se répandent et imprègnent le dogme
religieux. La science se limite globalement à des croyances, et
l’expérience est jugée inutile car reflet d’un monde physique
corrompu…
Et près de 20 siècles plus tard…
Après la mainmise d’Aristote sur les systèmes de pensées, il faudra bien longtemps pour que des
esprits aventureux (et malmenés) posent des questions subversives et fassent des démonstrations,
voire des expérimentation, particulièrement osées.
Giordano Bruno puis Galilée oseront affirmer que la Terre n’est pas au centre de l’Univers. Le
premier sera exécuté pour cela, le second passera la plupart de sa vie en geôle.
La science commence à faire de l’expérimentation la pierre angulaire de son édifice. Dans les
conceptions sur la structure de la matière, John Dalton est le premier à sortir les idées de Démocrite,
Leucippe et Empédocle de l’oubli ; il utilise la chimie expérimentale pour montrer que le concept
d’atomes de masses différentes permet d’expliquer ce qui se produit et de prévoir ce qui se passe.
L’avancée suivante sera celle des années de la radioactivité, découverte par Henri Becquerel en 1898.
La cohorte de particules radioactives, issues de la structure intime de la matière, va permettre les
hypothèses les plus folles sur cette matière microscopique que l’on ne peut voir directement.
430 av. J.-C. : naissance de l’atome
La matière ne peut pas être divisée infiniment : elle est faite de
grains insécables appelés atomes.
Démocrite (460-370 av. J.-C.)
1904 : le modèle du « plum-pudding »
Des électrons négatifs se répartissent à l’intérieur d’un noyau
positif, de la même façon que les pruneaux se dispersent dans un
cake.
Joseph John Thomson
(1856-1940)

Seconde – Sciences Physiques et Chimiques Activité 3.1
1ère Partie : L’Univers – Chapitre 3 Correction
2
Thomson, dont le nom est aujourd’hui associé à une célèbre marque hi-tech (téléviseurs notamment),
découvre l’électron en 1897 en étudiant les rayons cathodiques produits par le tube de Crookes. Ces
particules, composants intimes de la matière, lui ouvrent la voie du modèle du « plum-pudding »,
sorte de pain au raisins, où l’atome est une pâte chargée positivement dans laquelle baigne des
électrons négatifs.
En 1909, Ernest Rutherford (1871-1937) imagine une expérience qui devra révolutionner les
conceptions sur l’atome (voir activité 3.2). Cette expérience, qui montre que la matière contient
principalement… du vide ! L’atome de Rutherford présente un noyau, chargé positivement, puisque
c’est lui qui est responsable de la déviation des particules alpha (positives - issues de la radioactivité).
Ses conclusions permettront d’imaginer, quelques années plus tard, un modèle d’atome
particulièrement élégant…
1913 : le modèle planétaire
Les électrons tournent autour d’un noyau positif, comme les
planètes du système solaire tournent autour de notre étoile, le
Soleil.
Niels Hendrik Bohr
(1885-1962)
Ci-contre, le tube de Crookes à l’origine de la
découverte des rayons cathodiques puis des
électrons par Thomson.
Ci-dessous, le modèle du « plum-pudding ».

Seconde – Sciences Physiques et Chimiques Activité 3.1
1ère Partie : L’Univers – Chapitre 3 Correction
3
En 1919, après la Première Guerre mondiale, Rutherford récidivera : en bombardant de l’hydrogène
avec des particules alpha, il réalise la première transmutation artificielle (transformation d’un
élément chimique en un autre) et met en évidence l’existence du proton par l’observation. Le modèle
de l’atome s’affine, mais ce n’est pas encore fini...
Le modèle de Rutherford pose toutefois un problème : pourquoi les électrons circulant autour du
noyau ne perdent-ils pas de l’énergie en rayonnant, jusqu’à s’écraser sur le noyau, comme le
prévoient les lois de l’électromagnétisme énoncées par James Clerk Maxwell (1831-1879) ?
Reprenant les idées de Max Planck (1858-1947) sur la quantification1 de l’énergie, le danois Niels
Bohr (1885-1962, Nobel 1922) suggère, en 1914, que les électrons ne peuvent circuler que sur certaines
orbites, où ils ne rayonnent pas. Ils ne tombent donc pas. Dans ce modèle, les atomes ne peuvent
émettre ou absorber que certaines fréquences lumineuses, lorsqu’un électron « saute » d’une orbite à
l’autre ; ce modèle s’accorde bien à la spectroscopie de l’époque, qui a donné leur nom aux couches
dans lesquelles les électrons se répartissent autour du noyau.
Les limitations du modèle de Bohr tiennent essentiellement à la façon dont la quantification de
l’énergie a été introduite, qui reste très intuitive, pour ne pas dire artificielle. L’avènement de la
mécanique quantique bouleversera totalement ces conceptions classiques et proposera un formalisme
complexe, qu’on n’arrive pas toujours à expliquer en termes simples.
En 1924, Louis de Broglie2 (1892-1987, Nobel 1929) émet l’idée révolutionnaire selon laquelle les
particules de matière peuvent être considérées à la fois comme corpuscules ponctuels, mais aussi
comme ondes (dualité onde-corpuscule). L’expérience de diffraction des électrons menée en 1927 par
Clinton Davisson et Lester Germer viendra lui en apporter une preuve éclatante. Ce formalisme est
toujours utilisé aujourd’hui, mais les ondes en question ne sont pas réelles : il s’agit d’ondes
immatérielles de probabilité. En 1925-1926, l’autrichien Erwin Schrödinger (1887-1961, Nobel 1933)
décrit l’onde associée à l’électron par une équation, qui portera son nom. Il imagine pour cela une
nouvelle entité, la fonction d’onde : elle permet de calculer la probabilité que l’électron apparaisse à
tel ou tel endroit à l’issue d’une mesure. A peu de choses près, c’est ce modèle, difficile à se
représenter, qui est en vigueur aujourd’hui, du moins en ce qui concerne les électrons du noyau. Car,
en 1932, la découverte du neutron par le britannique James Chadwick (1891-1974) dévoilera que le
noyau est un assemblage de plusieurs particules, les nucléons (protons et neutrons)…
1 A l’échelle microscopique, l’énerie ne varie pas continument, mais par sauts discrets : on dit qu’elle est quantifiée.
2 Prononcer « breuille », à l’italienne…
1926 : le modèle quantique
Il faut abandonner le concept de trajectoire de l’électron. Celui-ci
est délocalisé dans le nuage électronique : on parle de probabilité
de présence de l’électron autour du noyau.
Erwin Schrödinger
(1887-1961)

Seconde – Sciences Physiques et Chimiques Activité 3.1
1ère Partie : L’Univers – Chapitre 3 Correction
4
En 1964, Murray Gell-Mann (1929-) et Georg Zweig (1937-) postuleront indépendamment l’existence
de particules plus élémentaires que les nucléons, les quarks3, dont la preuve expérimentale sera faite
en 1975. Actuellement, le LHC du CERN4, à Genève, entré en action en 2008, tente d’accroître encore
notre connaissance de la structure microscopique intime de la matière.
3Le mot quark provient d'une phrase du roman Finnegans Wake de James Joyce : « Three Quarks for Muster Mark! ».
4 Large Hadron Collider, accélérateur-collisionneur de hadrons installé au Centre Européen pour la Recherche Nucléaire.
L’atome d’hydrogène en mécanique quantique
:
l’électron a une probabilité plus ou moins grande de
se trouver çà et là, mais il ne peut être réellement
localisé à tout moment !
1
/
4
100%