Vers un thymus artificiel? - iPubli

S
: 331-2
à
à
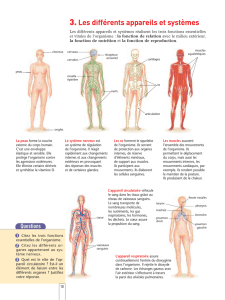
Le microenvironnement
thymique
Le thymus articiel : besoin et
caractéristique

332
R�F�RENCES
+
Edouard Potworowski
1-J
2
Jean-François Bach
· 2,
1
/
2
100%