CHAPITRE B

1
CHAPITRE B
L
Le
es
sM
Mé
éc
ca
an
ni
is
sm
me
es
sd
de
el
l’
’I
Im
mm
mu
un
ni
it
té
é

2
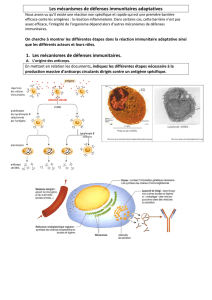
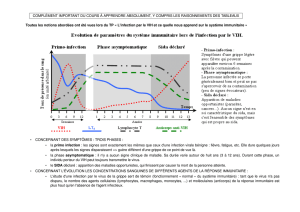
L’infection de l’organisme par un agent infectieux comme le VIH montre la mise en jeu du
système immunitaire qui se manifeste d’abord par une réaction immunitaire innée relayée
par une réaction immunitaire acquise. Les processus immunitaires impliquent des molécules
circulant dans le milieu intérieur, les anticorps, et des cellules comme les lymphocytes.
L’infection fait apparaître le rôle essentiel des lymphocytes T4.
Problématique :
ðComment agissent les anticorps et par quelles cellules sont-ils produits ?
ðQuelles sont les conditions de leur production ?
ðComment s’effectue l’élimination des cellules infectées par des virus ?
ðPourquoi dit-on que les LT4 constituent le pivot des réactions immunitaires ?
Nous avons vu, dans le chapitre précédent, que la contamination de l’organisme par le VIH
est suivie, quelques semaines plus tard, par l’apparition d’Ac anti-VIH dans le sérum du
patient qui devient séropositif.
Quelles sont les caractéristiques de ces molécules et comment apparaissent-elles dans le
sang ?
1. Les Ac, agents du maintien de l’intégrité du milieu extracellulaire.
a) La réaction antigène-anticorps et l’élimination des Ag.
Les anticorps apparaissent dans les flux extracellulaires (plasma, lymphe, lait maternel), à la
suite, de l’entrée d’un antigène étranger dans l’organisme. Ils appartiennent à la famille des
gammaglobulines, on les appelle aussi immunoglobulines (Ig). Les anticorps anti-VIH ont la
propriété de se fixer de façon très sélective sur des antigènes viraux c’est-à-dire des
protéines extraites du VIH. C’est une propriété générale de tous les anticorps.
ðLa chimie des anticorps (Ac = Immunoglobulines = Ig)
Un anticorps est une protéine complexe (glycoprotéine) (Document 7) qui résulte de
l’assemblage de quatre chaînes polypeptidiques identiques deux à deux : deux chaînes
lourdes (environ 400 acides aminés chacune) ou H (pour heavy) et deux chaînes légères
(environ 200 acides aminés chacune) ou L (pour light). Ces quatre chaînes sont reliées entre
elles par un ensemble de liaisons (ponts disulfures et liaisons faibles). L’ensemble constitue
une molécule en forme de Y.
Chaque chaîne protéique est formée d’une partie constante (=Fc = fragment constant)
identique d’une molécule d’Ig à l’autre, et d’une partie variable (= Fab = Fragment Antigen
Binding) ou paratope, à l’origine de sa spécificité. Les parties variables d’une chaîne légère et
d’une chaîne lourde, situées vis-à-vis, définissent le site de fixation à l’antigène.
Un Ac présente deux sites de fixation à l’antigène. Ces sites sont identiques et reconnaissent
non pas la molécule antigénique (le plus souvent une protéine) mais une partie seulement de
celle-ci, c’est un fragment peptidique ou épitope.
Les anticorps sont neutralisants et non destructeurs.

3
ðLa formation des complexes immuns : « une neutralisation » des antigènes.
Les anticorps sont des molécules solubles libérées dans les liquides extracellulaires et
capables de se lier, grâce à leurs sites anticorps, à des Ag dont la forme est
complémentaire à celle des sites : c’est la réaction antigène-anticorps ou complexe immun
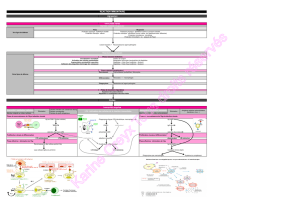
.TEST D’OUCHTERLONY
Ac par le-On peut reproduire in vitro cette réaction Ag
·Principe de la méthode d’Outcherlony :
C’est l’immunodiffusion : les réactifs déposés dans les puits diffusent de façon homogène
dans toutes les directions autour du puits.
Deux auréoles de diffusion peuvent donc entrer en contact lorsqu’elles ont suffisamment
grandi. Cette zone de contact reste invisible s’il n’y a pas de réaction entre les deux réactifs.
Par contre, elle se traduit par un arc de précipitation visible à l’œil nu lorsque les deux
réactifs interagissent.
·Résultats :

4
-Si l’Ag est lui-même une molécule soluble (toxine microbienne, par exemple), le
résultat est la formation de complexes immuns insolubles qui précipitent .
Complexes immuns insolubles
-Si les molécules antigéniques sont fixées sur la paroi d’une cellule, cette dernière est
alors recouverte d’Ac.
Complexes immuns
La formation des complexes Ag-Ac permet la neuralisation des Ag.
Remarque : Comparaison Outcherlony / Elisa / Western Blot
Méthodes Ouchterlony ELISA Western Blot
Mise en évidence de
la réaction Arc de précipitation Coloration diffuse Coloration limitée à la
zone de réaction
Ag/Ac (bande)
Ac Intermédiaire Non Oui Oui
Lavages Non Oui Oui
Ag détectés Plusieurs Ag détectés
en même temps Un seul Ag Plusieurs Ag détectés
en même temps
Coût Peu coûteux Couteux Très couteux
Fiabilité Très peu fiable Fiable Très fiable
Support Gel de Diffusion Puits recouverts d’Ag Gel d’électrophorèse
où ont migré
différents Ag
Utilisation en
laboratoire pour le
dépistage de la
séropositivité
Non Oui Oui, en confirmation,
si un des 2 tests Elisa
est positif

5
Quel est le mécanisme immunitaire qui permet l’élimination définitive des complexes
immuns ?
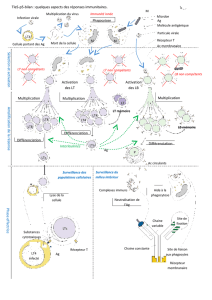
ðLa phagocytose, un mécanisme inné d’élimination des complexes immuns (Document
8)
La phagocytose est assurée par deux principaux types de phagocytes : les granulocytes
(ou polynucléaires) d’une part et les macrophages (et les monocytes sanguins) d’autre
part. Ces cellules immunitaires ont la capacité d’absorber des éléments étrangers ou
anormaux (complexes immuns précipités, débris cellulaires, cellules cancéreuses,
bactéries, cellules infestées par un virus, …)
La phagocytose est réalisée en 3 étapes :
ðLa membrane du phagocyte adhère à la bactérie, par ex, qui est finalement enfermée
dans une vésicule cytoplasmique, le phagosome (on parle d’endocytose).
ðLes lysosomes, riches en enzymes hydrolytiques, s’accolent au phagosome et forment
un phagolysosome. Ces lysosomes déversent leur contenu.
ðL’élèment étranger est digéré et les déchets sont rejetés hors de la cellule par
exocytose.
Dans certains cas, certaines particules de l’élément étranger sont présentées par le
macrophage et celui-ci devient une CPA (cellule présentatrice d’antigène).
Cette phagocytose est facilitée par la présence d’anticorps. En effet, une bactérie
recouverte d’Ac ou un complexe immun exposent en surface les fragments constants, ou
Fc, des Ac. Or la membrane des phagocytes ont des récepteurs membranaires capables
de se fixer de manière spécifique à cette région constante (Document 9). L’adhérence
indispensable entre le phagocyte et la bactérie, par exemple, est facilitée.
C’est donc la phagocytose qui assure finalement l’élimination des complexes immuns.
Quelles cellules sont responsables de la production d’Ac dans le sang ?
Comment l’organisme peut-il produire massivement le type d’Ac spécifique de l’Ag ?
b) L’origine des Ac.
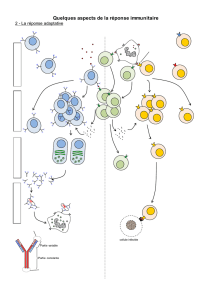
ðLes plasmocytes, cellules sécrétrices d’Ac.
Les Ac circulants dans le milieu intérieur sont sécrétés par des plasmocytes. Ce sont de
gros lymphocytes spécialisés dans la synthèse des protéines (immunoglobulines) : un
plasmocyte peut sécréter jusqu’à 5000 molécules d’Ac, toutes identiques, par seconde.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%