Récepteurs et médiateurs de l`immunité innée

Cours du mardi 11 décembre 2007 15h-17h
ronéo par Alexis Régent mail : alexis[email protected]
professeur Mme Cremer mail : isabelle.cremer@upmc.fr
Récepteurs et médiateurs de l’immunité innée
Introduction
Def : mécanisme de défense contre la plupart des pathogènes. La caractéristique importante
étant son début immédiat après contact avec le pathogène.
La plupart des cellules du système immunitaire expriment des PRR (pattern-recognition-
receptor) et sont donc susceptibles de reconnaître des pathogènes. Ces récepteurs
reconnaissent des molécules aux motifs structuraux très conservés et présents sur l’enveloppe
des microorganismes (phospholipides, carbohydrates…)mais absents sur les cellules
eucaryotes.
Ces structures reconnues sont des PAMPs (pattern-associated-molecular-patterns).
Comparaison entre le système inné et le système adaptatif ( un peu fictif car il existe des
interconnexions entre les deux systèmes ).
Système inné Système adaptatif
Origine Archaïque déjà présent sur plantes….
400 millions d’années, retrouvé
chez les vertébrés à mâchoires
Motif reconnu Motifs conservés (PAMPs) Détail spécifique de la structure
moléculaire (peptides) avec notion
de processing (clivage,…) pour
aboutir aux antigènes
Récepteurs PRR invariants sans réarrangement,
pas de clonalité, distribution
cellulaire variée (PNN, PNE,
monocytes, macrophages,….)
TcR et Bcr qui ont subis des
réarrangements, avec clonalité et
spécificité entre interaction
antigène-récepteur
Discrimination
soi/non soi Théoriquement parfaite Imparfaite (ex. des maladies auto-
immunes)
Délai Immédiat Retardé
Mémoire Absente Présente

I) Les récepteurs de l’immunité innée
L’immunité innée comprend 3 étapes : reconnaissance, activation et augmentation des
chimiokines et cytokines inflammatoires (IL1, IL 6, IL8, TNF α…)
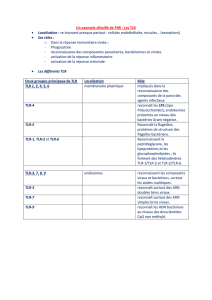
Il existe 3 types de récepteurs PRR :
- les récepteurs solubles (1 famille)
- les récepteurs trans-membranaires dont la famille des TLR (Toll-like-receptor) (5
familles)
- les récepteurs intra-cellulaires (1 famille). Ce sont les NOD.
Pour détailler ces 7 familles de récepteurs :
1)Les récepteurs solubles comprennent les collectines et les ficolines, ce sont des récepteurs
circulant qui peuvent fixer les pathogènes (leishmania…).
2)Les lectines de type C. Ce sont des récepteurs qui permettent la phagocytose
ex : -MMR pour Mannose-Macrophage-Receptor qui reconnaît le mannose
-dectine qui reconnaît le groupement β-glucan des levures
-DC-sign sécrété par les cellules dendritiques mais aussi les macrophages
3)Les récepteurs scavanger (veut dire poubelle) qui reconnaissent les corps apoptotiques ou
les produits du métabolisme lipidique (reconnaît le LPS mais aussi plasmodium…)
4)Les TLR avec 11 types clonés à ce jour. Ce sont des récepteurs trans-membranaires qui
peuvent agir en monomères ou en hétéro dimères (TLR2/TLR1 et TLR2/TLR6)
-Le TLR4 fonctionne avec des protéines accessoire car seul ne reconnaît pas le
LPS. Nécessite la LBP (LPS-binding-protein)
-Le TLR3 dont on connaît un seul ligand DNA double brin (rôle dans les
infections virales…)
-Le TLR5 qui lie la flagelline
-Le TLR 7 et 8 qui lient l’ADN hypométhylé (bactérien) car l’ADN des
mammifères est plutôt méthylé.
-TLR9 qui lie les complexes immuns et le DNA
-Le TLR 10 dont le ligand est inconnu
5)et 6)Les récepteurs du complément sous divisés en récepteurs du complément et en
récepteurs des Fc (FcR) qui aident à la phagocytose des complexes immuns et sont donc à
cheval entre inné et adaptatif
7)Les récepteurs NOD qui reconnaissent en intracellulaire des éléments de type LPS
II) Les Toll Receptor
Toll a été découvert chez la drosophile et a 2 rôles essentiels : dans l’ontogenèse, il assure la
polarité dorso-ventrale et il est également responsable de résistance anti-microbienne.
Plusieurs homologues ont été découverts chez les vertébrés clonés identifiés, ce sont les Toll-
like-receptor (TLR). Ces ont des protéines transmembranaires, phylogénétiquement
conservées.
Chez la drosophile :
-reconnaissance du ligand par le récepteur TOLL

-voie de transduction activée
1
er
acteur est MyD88 qui est un adaptateur moléculaire et qui permet le recrutement
d’enzymes notamment tube et pell qui sont des kinases.
-activation d’un facteur de transcription (DIF) qui appartient à la famille des protéines NF-κB
-fixation sur le promoteur du gêne et activation de la transcription de peptides antimicrobiens
comme la drosomycine ou la défensine.
III) Les Toll Like Receptor
1) Généralités
Famille de 11 récepteurs transmembranaires (en surface ou au sein de la paroi de l'endosome)
Fonction de reconnaissance des PAMPs. De façon spécifiques, ils reconnaissent un ou
plusieurs ligands
Certains nécessitent des protéines accessoires (TLR4)
2) Biochimie
Ce qui caractérise les TLR sont :
-des domaines répétés riches en leucine (LRR)
-une portion transmembranaire
-une portion TIR (toll interleukine receptor) qui a été retrouvé sur les récepteurs à
interleukine IL1 et IL 18 d'où son nom. MyD88 par son domaine TIR va pouvoir interagir
avec ce domaine TIR du récepteur TLR.
Les récepteurs TLR6/TLR2, TLR1/TLR2, TLR5 et TLR4 reconnaissent des éléments à la
surface des bactéries. Ils sont présents au niveau de la membrane cytoplasmique
Les récepteurs TLR3, TLR7, TLR8 et TLR 9 restent à l'intérieur de la cellule au niveau de
l'endosome (ce qui est logique puisque ce sont des récepteurs aux acides nucléiques qui
nécessite une digestion de la bactérie pour pouvoir être activés par ces acides nucléiques)
3) Transduction du signal
L'ojectif final est la production de cytokines inflammatoires de chimiokines et d'interféron de
type 1 (i.e. α ou β). (ne pas confondre avec l'IFN de type 2 (i.e. γ) qui est surtout retrouvé dans
l'immunité adaptative)
Le TLR avec sa portion TIR intracellulaire va recruter MyD88 (là aussi par son domaine
TIR). Il y a ensuite une activation d'IRAK (kinase) puis de TRAF qui va libérer NF-κB qui
était lié à IκB. NF-κB peut alors se transloquer dans le noyau et activer les promoteurs
responsables de la synthèse des interleukines (IL1, IL6,…) et des IFN de type 1.
On pensait initialement que MyD88 était le seul adaptateur pour tous les TLR, en fait on a mis
en évidence d'autres adaptateurs : TRIF (ou TICAM1), TIRAP (ou MAL), TRAM (ou
TICAM2). En aval de façon identique, il y a une cascade de kinases.

Il existe donc des voies MyD88 dépendantes et des voies MyD88 indépendantes.
Rappel, TLR4 ne peut pas reconnaître le LPS seul et nécessite LBP ainsi que le CD14. C'est
ce complexe LBP, CD14 qui se rapproche de TLR4 et qui fonctionne par la suite avec MD2…
4) Mise en évidence du rôle des TLR
- rôle du TLR 4
on prend 4 types de souris
la souris lps qui a un récepteur TLR4 naturellement déficient
la souris L3H/HeJ qui a une mutation du domaine TIR deTLR4 le rendant inefficace
la souris KO pour TLR 4 (TLR4-/-)
la souris KO pour le CD14 (CD14-/-)
Ces différents souches sont plus sensibles aux infections par les bactéries gram négatif (par
défaut de reconnaissance ou de transduction).
Par contre, ces souris sont résistantes au LPS. Normalement, avec de fortes doses de LPS, la
souris fait un choc septique car l'IFN entraîne une augmentation de la perméabilité vasculaire.
Les souris mutantes ou déficientes ne font pas de choc car elles ne produisent pas d'IFN.
-rôle des autres TLR
des souris KO pour les différents TLR, les protéines adaptatrices ont été effectuées
Souris KO pour TLR4
Pas de réponse au
LPS Réponse au PG Sensibilité aux BGN
Souris KO pour TLR2
Réponse au LPS Pas de réponse au PG Sensibilité au BGP
Souris KO pour
Myd88 Pas de réponse au
LPS Pas de réponse au PG Sensibilité BGP et
BGN
Souris contrôle Réponse au LPS Réponse au PG normal
PG = peptidoglycane; BGN = bactéries gram négatif; BGP = bactéries gram positif.
III) Liens entre immunité innée et acquise
1) Zoom sur le rôle des interférons
L’IFN joue un rôle sur l’immunité innée mais aussi dans l’immunité adaptative.
IRF = IFN responsive factor
En réponse à une activation de TLR4 et de TLR3, on a une activation d’IRF3 qui conduit à la
synthèse d’IFNβ.
Pour le TLR3 ou 4 :
-il y a une voie dépendante de MyD88 qui conduit à la production de cytokines
inflammatoires.
-Il y a une voie MyD88 indépendante (via TRIF) qui conduit à la synthèse d’IFN β
(l’IFNβ permet d’augmenter la présentation de l’antigène).

Pour TLR 7, 8 ou 9 :
-il y a une voie dépendante de MyD88 qui aboutit à la production d’IRF7 et à la synthèse
d’IFNα.
Au total, l’activation des TLR entraîne
-une réaction inflammatoire par la production de TNFα, d’IL6, d’IL8, d’IL12, d’IL1
-une réponse antivirale par la production de IFN de type 1 (α ou β)
-une activation de l’immunité adaptative (IFN de type 1 et IL 12) qui augmente les
molécules de co-stimulation CD80 et CD86 et qui fait maturer les cellules présentatrices
de l’antigène (CPA).
2) rôle dans la maturation cellulaire
Pour rappel, les IL et le TNF conduisent à :
-une activation de l’endothélium vasculaire et permettent le recrutement de cellules de
l’immunité innée ( PNN et macrophages sanguins et LyB ou LyT situés dans les
ganglions)
-induisent une fièvre
-permettent la synthèse des protéines de la phase aiguë de l’inflammation
Les CPA (cellules dendritiques +++) expriment des PRR dont les TLR et elles ont un rôle
majeur dans le lien inné-adaptatif.
On les retrouve dans 2 états :
-l’état immature en périphérie ou elles peuvent phagocyter les agents pathogènes et ou
la présentation de l’antigène est de mauvaise qualité.
-une forme mature qui ne sait plus faire de phagocytose, qui devient apte à présenter
l’antigène et qui migre pour rejoindre les organes lymphoïdes secondaires. Ce sont en partie
les IFN qui font migrer les cellules et participent à leur maturation.
Par leurs PRR, les CD permettent :
-une reconnaissance du pathogène
-une augmentation de l’expression du CMH II et une augmentation de la phagocytose
permettant un chargement des antigènes sur les CMH de classe I ou II et la présentation
antigénique auprès des Ly T.
-une augmentation de la production de l’IL12.
-une modification de l’expression des récepteurs des chimiokines permettant une
migration cellulaire.
Ex :CLR 6 retient le cellule en périphérie et en maturant, la cellule exprime
CLR7 qui n’a pas de ligand en périphérie mais par contre il existe des ligands à CLR7
dans les organes lymphoïdes secondaires.
Comment montrer que les TLR sont importants dans la maturation cellulaire ?
L’adaptateur moléculaire est MyD88, on crée donc des cellules KO pour Myd88 et on
regarde l’expression de CD80/CD86 :
-Si la cellule est Myd88 + on constate une augmentation de CD80/CD86 ce qui n’est
pas le cas pour les cellules KO pour MyD88.
 6
6
 7
7
1
/
7
100%