Transferts thermiques

34
Transferts thermiques
JAMES JOULE (1818—1889)
34.1 Rappels de Thermodynamique
34.1.1 Le premier principe
Énergie mécanique
Le théorème de l’énergie cinétique pour un système matériel Σaffirme la conservation de l’énergie mécanique totale d’un
système soumis à des efforts conservatifs; cette énergie totale s’écrit :
E=Ec+EpEc=1
2mΣ~v2
G+E∗
cEp=Ei
p+Ee
p(34.1)
où on a distingué l’énergie cinétique barycentrique E∗
c, ainsi que les composantes intérieure Ei
pet extérieure Ei
pde l’énergie
potentielle dont dériventles forces exercées sur le système. Compte tenu de l’absence de forces nonconservatives au niveau
microscopique, le caractère isolé d’un système matériel impose ∆E=0.
Énergie interne
Nous ne nous intéresserons dans la suite qu’à la seule partie de l’énergie mécanique totale qui ne dépend que du système
seul, étudié dans un référentiel où son centre de masse Gest, à un instant donné, au repos. Cette partie de Eporte le nom
d’énergie interne U1:
1Dans la suite, sauf mention expresse, nous négligerons l’énergie cinétique de translation et les interactions potentielles avec l’extérieur, ce qui permet
de confondre2Eet U.

258 Manuel de Physique
U=E∗
c+Ei
pE=U+1
2mΣ~v2
G+Ee
p(34.2)
Le premier principe
Le premier principe de la Thermodynamiqueindique que l’énergie interneUdu système est une fonction d’état. Dans le cas
où le système n’est pas isolé, on s’attend a priori à une variation de cette énergieinterne du système, du fait des interactions
énergétiques avec l’extérieur.
34.1.2 Travail, Chaleur
Transfert de travail
La partie des échanges énergétiques qui correspond nécessairement à la variation d’un paramètre extensif macroscopique
porte le nom de transfert de travail.
Ainsi, on pourra observer, pour le travail des forces de pression exercées sur un fluide, pour les forces de traction ou encore
pour les forces électriques, les expressions :
δW=−pextdV δW=FextdL δW=−eextdq
Transfert thermique
On appelle ainsi la partie non macroscopique des échanges énergétiques, soit dU −δW, soit :
dU =δW+δQou encore ∆U=W+Q(34.3)
L’expression « transfert thermique » a récemment été introduite pour remplacer le terme « chaleur », source de possibles
confusions entre les notions de transfert thermique (extensif, lié à une transformation) et de température (intensif, lié à un
état).
La confusion a été levée de façon explicite pour la première fois vers 1760 par le physicien britannique JOSEPH BLACK
(1728-1799); il nommait alors intensity of heat la température et quantity of heat le transfert thermique.
34.2 Description des transferts thermiques
34.2.1 Généralités
Historique
La controverse concernant la nature de la “chaleur” durèrent jusqu’au milieu du XIXième siècle. Cependant, vers 1805,
le physicien et mathématicien français JOSEPH FOURIER (1768-1830), reprenant des travaux antérieurs, décida de faire
complètement abstraction de la nature de la chaleur, pour se concentrer que l’étude de sa transmission.
Fourier supposa que la chaleur se transmet des zones chaudes vers les zones froides perpendiculairement aux surfaces
isothermes et proportionnellement aux écarts de température existants. Il aboutit ainsi à la première étude quantitative d’un
mode de transfert thermique, la conduction; c’est aussi le premier que nous étudierons en détail. La résolutionde l’équation
aux dérivées partielles obtenue amena Fourier à développer les notions de séries et intégrales de Fourier.
Transferts thermiques
Nous étudions ici un ensemble de systèmes thermodynamiques qui ne se trouve pas à l’équilibre thermique, c’est-à-dire
lorsque la température d’un système particulier Σn’est pas partout égale à la température du ou des autres systèmes avec
lesquels Σest en contact, ou en relation par rayonnement électromagnétique.
La description que nous ferons des transferts thermiques sera phénoménologique, c’est-à-dire d’origine expérimentale,
même su une analyse microscopique simplifiée permettra de justifier certaines de ces lois.

Transferts thermiques 259
Température
Le système thermodynamique étudié Σsera bien sûr macroscopique, ce qui ne l’empêchera pas d’être de faible dimen-
sion à notre échelle. En particulier, nous ne nous priverons pas de considérer le cas de systèmes inhomogènes sur le plan
thermique; le système thermodynamique de base sera donc l’élément de volume dτ, infinitésimal à notre échelle, et ce-
pendant macroscopique, c’est-à-dire contenant un nombre dN de particules très élevé, même si la quantité de matière dn
correspondante est très faible. La température d’un tel élément de volume sera notée T(~r,t). L’échelle de dimensions cor-
respondante porte le nom d’échelle mésoscopique; elle occupe une position intermédiaire entre les échelle microscopique
et macroscopique :
microscopique mésoscopique macroscopique
mais l’ordre de grandeur des dimensions mésoscopiques peut être très variable, compris entre quelques micromètres et
quelques kilomètres, selon les dimensions caractéristiques du système étudié.
Nous rencontrerons des situations normales où la température Test une fonction continue de l’espace, mais aussi des
modélisations extrêmes où cette température subit des variations très rapides sur de faibles dimensions, que l’on considérera
donc parfois comme des zones de discontinuité de la température (au niveau d’une paroi par exemple).
34.2.2 Les modes de transfert
Les transferts thermiques au sein de systèmes hors d’équilibre thermique se font principalement par trois modes et par leurs
combinaisons.
Conduction
Le mode de transfert qui apparaît toujours au sein d’un milieu continu (solide ou fluide) thermiquement inhomogène est
la conduction thermique, consistant en des transferts thermiques de proche en proche, par chocs microscopiques entre
particules d’énergie cinétique moyenne différente.
La conduction thermique sera associée à un courant local d’échanges thermiques causés par l’existence d’un gradient de la
température dans le milieu continu étudié.
Convection
La convection désigne, en général, le transport d’une quantité physique lié à un transfert de masse observable à l’échelle
macroscopique.Nous l’étudieronsdonc dans un fluide relativement à un certain système de référenceR, relativement auquel
les particules passant au point Pdu fluide ont, à un certain instant t, la vitesse~v(P,t).
Si l’étude détaillée de la convection n’est pas au programme, nous étudierons de façon assez complète l’existence de flux
thermiques conductifs liés aux phénomènes de convection, qui apparaissent aux frontières (parois, canalisations) des sys-
tèmes thermodynamiques; on parlera de transfert pariétal.
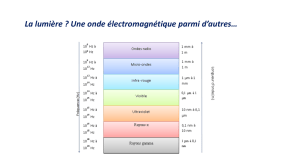
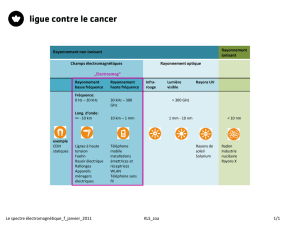
Rayonnement
Le rayonnement constitue le troisième mode de transfert thermique; il ne nécessite pas de support matériel car il constitue
un transport énergétique par une onde électromagnétique qui, comme on le verra par la suite, se propage dans le vide ou
bien dans certains milieux matériels; nous nous limiterons au cas des milieux transparents, qui se comportent, du point de
vue du rayonnement, pratiquement comme le vide.
34.3 Transports énergétiques dans les systèmes ouverts
34.3.1 Systèmes ouverts
Définitions
Les systèmes ouverts sont des systèmes comportant un nombre de particules élevé (systèmes thermodynamiques) et non
nécessairement constant, du fait d’un apport continu de matière en entrée et d’une évacuation de matière en sortie.
Les différentes grandeurs extensives (notamment les grandeurs énergétiques) associées à ce système peuvent aussi varier du
fait, par exemple, de transformations chimiques ou de changements d’état.

260 Manuel de Physique
Nous appellerons donc système ouvert (Σ)l’ensemble de la matière comprise, à un instant quelconque, à l’intérieur d’une
surface fermée (A), dite surface de contrôle, fixe dans le référentiel d’étude.
Bilans de grandeurs extensives
Considérons une grandeur physique extensive Xpour un milieu continu (fluide ou solide); elle peut être de nature thermo-
dynamique (fonctions d’état U,H,S, ...) ou non (masse, impulsion). Son caractère extensif permet de la décrire par une
intégrale de volume, la grandeur Xcontenue dans le volume (τ)intérieur à la surface de contrôle (A)ayant les expressions :
X=Zτxµdτ
en fonction de la densité massique xde la grandeur Xet de la masse volumique µdu milieu continu.
Au cours d’un intervalle de temps δt, la grandeur Xcontenue dans le volume invariable (τ)limité par la surface de contrôle
fixe (A)varie pour deux raisons : d’abord, localement en chaque point Pde (τ), le densité xdépend du temps; ensuite, aux
frontières de (τ), de la matière entre ou sort de (τ), entraînant avec elle un certain flux de X.
Nous noterons dérivée totale ou dérivée particulaire de X la grandeur :
DX
dt =lim
δt→0
X(t+δt)−X(t)
δt
où X(t+δt)est la valeur de Xdans le volume (τ0)occupé, à l’instant t+δt, par les mêmes particules qui occupaient à
l’instant tle volume (τ).
Cette dérivée, calculée en suivant individuellement les particules en mouvement dans le milieu continu, n’est pas égale à la
dérivée locale de X, qu’on définira par :
∂X
∂t=Zτ∂
∂t(µx)dτ
et qui ne tient compte que des variations locales de X, mais pas de la convection de X, c’est-à-dire du transport de la grandeur
Xassocié au déplacement de matière entrant ou sortant de (τ).
On doit donc ajouter à cette variation les termes de flux sortants (cf. démonstration dans le cours de Thermodynamique),
d’où :
DX
dt =∂X
∂t+IAµx~v·~ndS
Ce débit s’identifie à un flux du vecteur densité locale de courant de Xnoté ~
jX=µx~v. On notera la forme synthétique, qui
porte le nom de formule de Reynolds :
DX
dt =∂X
∂t+D(X)(34.4)
Premier principe de la Thermodynamique
Le théorème de l’énergie cinétique peut être écrit pour un système ouvert, sous la forme, fonction de l’énergie mécanique
massique em:
DE
dt =∂E
∂t+IAµem~v·~ndS =Pm+Pt
faisant intervenir les puissances mécanique Pmet thermique Ptreçues par le système.
La puissance mécanique se décompose en puissance utile Puet puissance des forces pressantes P0, avec :

Transferts thermiques 261
P0=−IApdS~n·~v
On remarque donc enfin que :
∂E
∂t+IAµem+p
µ~v·~ndS =Pu+Pt
Enthalpie
On peut aussi noter que em=u+1
2~v2+epet que u+p
µ=h, en fonction des grandeurs massiques enthalpie h, énergie interne
u, énergie potentielle ep; on a donc finalement pour expression du premier principe pour un système ouvert :
Zτ
∂
∂tu+1
2~v2+epdτ+IAµh+1
2~v2+ep~v·~ndS =Pu+Pt
Notamment, le cas des régimes permanents se traite simplement sous la forme :
IAµh+1
2~v2+ep~v·~ndS =Pu+Pt
qui prend la forme utilisée dans l’étude des bilans thermiques, DH+1
2m~v2
G+Ep=Pu+Pt.
34.3.2 Bilans thermiques
Enthalpie et énergie interne
La relation H=U+pV montre que H'Upour les phases condensées, de volume faible.
Si, pour les milieux continus peu compressibles (solides, liquides), la distinction entre enthalpie massique het énergie
interne massique uest anecdotique, il n’en va pas de même des gaz; remplacer hpar ureviendrait à oublier l’existence
inévitable de forces de pression, qui travaillent lors de la convection.
Rappelons encore les expressions des capacités thermiques massiques :
cp=∂h
∂Tpcv=∂u
∂Tv
Compte tenu de la remarque qui précède, on considérera souvent ces deux valeurs comme voisines pour des phases conden-
sées : cp'cv'c, où la capacité thermique massique cest pratiquementindépendante de la naturede la transformationsubie
par le système. Au contraire, pour les gaz, cp−cv'R
M=ret γ=cp
cvpermettent de déterminer cv=r
γ−1et cp=γr
γ−1.
Dans de nombreux autres cas, on notera de manière indifférente :
c=∂u
∂T(34.5)
définissant ainsi la capacité thermique massique dans les conditions de la transformation, sans préciser celle-ci a priori.
Ces conditions ne modifient pas de façon significative la valeur de csi le système est dans une phase condensée.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
1
/
46
100%